题目内容
【题目】有A、B、C、D四种元素,它们的原子序数依次增大,但均小于18,A和B在同一周期,A原子的电子式为 ![]() ,B原子L层的电子总数是K层的3倍;0.1mol C单质能从酸中置换出2.24L氢气(标准状况),同时它的电子层结构变成与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同.
,B原子L层的电子总数是K层的3倍;0.1mol C单质能从酸中置换出2.24L氢气(标准状况),同时它的电子层结构变成与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同.
(1)元素A、B、C、D分别是:A , B , C , D .
(2)D元素在周期表中属第周期族.
(3)用电子式表示A的气态氢化物的形成过程: .
(4)A和B的单质充分反应生成化合物的电子式是 .
(5)B与C形成的化合物是离子化合物还是共价化合物?如何证明; .
【答案】
(1)碳;氧;镁;铝
(2)三;ⅢA
(3)![]() +4H→
+4H→ 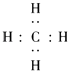
(4)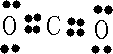
(5)离子化合物;检验方法为:验证其熔融物是否导电,若导电则为离子化合物,若不导电则为共价化合物
【解析】答案:(1)B原子L层的电子总数是K层的3倍,则B的原子原子核外各层电子数分别为2、6,应为O元素,根据A的电子式可知A的最外层有4个电子,应为周期表第ⅣA族元素,又原子序数小于O,应为C元素,0.1mol C单质能从酸中置换出2.24L氢气(标准状况),则C的最外层有2个电子,离子的与氖原子的电子层结构相同,则C为Mg元素,D离子的半径比C离子的小,D离子与B离子的电子层结构相同,D应为Al元素,故答案为:碳,氧,镁,铝;(2)D为Al元素,原子序数为13,原子核外有3个电子层,最外层电子数为3,位于周期表第三周期ⅢA族,
故答案为:三,ⅢA;(3)A的气态氢化物为CH4 , 用电子式表示形成过程为 ![]() +4H→
+4H→  ,故答案为:
,故答案为: ![]() +4H→
+4H→ 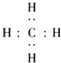 ;(4)A和B的单质充分反应生成化合物为CO2 , 电子式为
;(4)A和B的单质充分反应生成化合物为CO2 , 电子式为 ![]() ,故答案为:
,故答案为: ![]() ;(5)B与C形成的化合物为MgO,为离子化合物,可用熔融状态下是否导电验证,离子化合物在熔融状态下导电,而共价化合物不导电,
;(5)B与C形成的化合物为MgO,为离子化合物,可用熔融状态下是否导电验证,离子化合物在熔融状态下导电,而共价化合物不导电,
故答案为:离子化合物;检验方法为:验证其熔融物是否导电,若导电则为离子化合物,若不导电则为共价化合物.
B原子L层的电子总数是K层的3倍,则B的原子原子核外各层电子数分别为2、6,应为O元素,根据A的电子式可知A的最外层有4个电子,应为周期表第ⅣA族元素,又原子序数小于O,应为C元素,0.1mol C单质能从酸中置换出2.24L氢气(标准状况),则C的最外层有2个电子,离子的与氖原子的电子层结构相同,则C为Mg元素,D离子的半径比C离子的小,D离子与B离子的电子层结构相同,D应为Al元素,根据元素对应的原子结构以及形成化合物的性质解答该题.






