题目内容
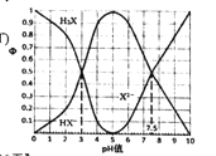
【题目】在25°C时,某二元酸H2X及其钠盐的溶液中,H2X、HX-、 X2-分别在三者中所占的物质的量分数(Φ)随溶液pH变化关系如下图所示,下列叙述不正确的是( )
A.在pH=5 的溶液中,存在 =10-4.5
=10-4.5
B.在pH=7.5的溶液中,存在3c(HX-)=c(Na+)+c(H+)-c(OH-)
C.将相同物质的量的Na2X和NaHX完全溶于水所得溶中液的pH值为7.5
D.等体积等浓度的NaOH溶液与H2X溶液混合,溶液显酸性且存在c(H+)+(H2X)=c(OH-)+c(X2-)
【答案】C
【解析】
如图当pH值为3,c(HX-)=c(H2X),Ka1(H2X)=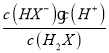 =1.0×10- 3,当pH值为7.5,c(X2- ) = c(HX-),Ka2(H2X)=
=1.0×10- 3,当pH值为7.5,c(X2- ) = c(HX-),Ka2(H2X)= = 1.0×10-7.5, X2-发生两步水解,
= 1.0×10-7.5, X2-发生两步水解,![]() ,
, ![]() 。
。
A. 二元酸H2X存在两步电离,H2X![]() HX-+H+,Ka1=1.0×10- 3,HX-
HX-+H+,Ka1=1.0×10- 3,HX-![]() X2- + H+,Ka2=1.0×10-7.5,
X2- + H+,Ka2=1.0×10-7.5,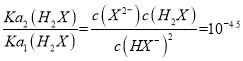 ,A说法正确;
,A说法正确;
B. 在pH=7.5的溶液中,HX-和 X2-物质的量分数相同,c(HX-)= c(X2--),此时溶液中存在电荷守恒c(OH-)+2c(X2--)+c(HX-)=c(Na+)+c(H+),故3c(HX-)=c(Na+)+c(H+)-c(OH-)等式正确,B说法正确;
C. NaHX中HX-的水解能力(![]() =1.0×10-11)小于其电离能力(
=1.0×10-11)小于其电离能力(![]() =1.0×10-7.5),以电离为主。Na2X中X2-的水解能力(
=1.0×10-7.5),以电离为主。Na2X中X2-的水解能力(![]() =1.0×10-6.5)大于NaHX中HX-的电离,故若将相同物质的量的Na2X和NaHX完全溶于水,那么溶液中c(HX-)>c(X2--),此时pH值>7.5,C说法错误;
=1.0×10-6.5)大于NaHX中HX-的电离,故若将相同物质的量的Na2X和NaHX完全溶于水,那么溶液中c(HX-)>c(X2--),此时pH值>7.5,C说法错误;
D. 等体积等浓度的NaOH溶液与H2X溶液混合,二者按照一比一恰好反应完全生成NaHX,其质子守恒为c(H+)+(H2X)=c(OH-)+c(X2-),D说法正确;
答案选C。

【题目】I.《自然》杂志曾报道我国科学家通过测量SiO2中26Al和10Be两种元素的比例确定“北京人”年龄的研究结果,这种测量方法叫“铝铍测年法”。完成下列填空:
(1)l0Be和9Be_____________(填序号)。
a.是同一种原子 b.具有相同的中子数 c.具有相同的化学性质 d.互为同位素
(2)写出A1(OH)3与NaOH溶液反应的化学方程式:_________________________。
(3)研究表明28A1可以衰变为26Mg,可以比较这两种元素金属性强弱的方法是____________(填序号)。
a.比较Mg(OH)2与A1(OH)3的碱性强弱
b.比较这两种元素的最高正化合价
c.将打磨过表面积相同的镁条和铝片分别和100℃热水作用,并滴入酚酞溶液
d.比较这两种金属的硬度和熔点
II.下表列出了①~⑩10种元素在周期表中的位置。
周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑤ | ⑥ | ⑩ | |||||
3 | ① | ③ | ④ | ⑦ | ⑧ | |||
4 | ② | ⑨ |
(1)上述元素中,金属性最强的是(填元素符号,下同)________,③④⑤三种元素的原子半径由大到小的顺序是____________。
(2)上述元素的最高价氧化物对应的水化物中酸性最强的是________(填化学式)
(3)元素⑥的氢化物的电子式为____________,该氢化物与元素⑥的最高价氧化物对应的水化物反应的化学方程式为_______________________________________。
【题目】开发清洁能源是当今化工研究的一个热点问题。二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用,工业上以CO和H2为原料生产CH3OCH3。工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g)CH3OH(g) ΔH1=-99kJ·mol1
②2CH3OH(g)CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol1
③CO(g)+H2O(g)CO2(g)+H2(g) ΔH3=-41.2kJ·mol1
(1)催化反应室中的总反应3CO(g)+3H2(g)CH3OCH3(g)+CO2(g),计算ΔH=_______。反应来自煤的气化。已知该反应的平衡常数表达式为K=![]() ,每生成1mol H2需要吸收131.3kJ的热量。写出该反应的热化学方程式____________。
,每生成1mol H2需要吸收131.3kJ的热量。写出该反应的热化学方程式____________。
(2)在该条件下,若反应①的起始浓度分别为:c(CO)=0.6mol·L1,c(H2)=1.4mol·L1,8min后达到平衡,CO的转化率为50%,则8min内H2的平均反应速率为__________。
(3)在t℃时,反应②的平衡常数为400,此温度下,在1L的密闭容器中加入一定的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
c(mol·L1) | 0.46 | 1.0 | 1.0 |
此时刻v正___v逆(填“>”“<”或“=”),平衡时c(CH3OCH3)的物质的量浓度是___。
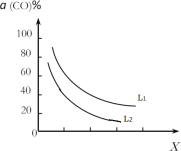
(4)在(1)小题中催化反应室的总反应3CO(g)+3H2(g)CH3OCH3(g)+CO2(g),CO的平衡转化率a(CO)与温度、压强的关系如图所示,图中X代表___(填“温度”或“压强”),且L1___L2(填“>”“<”或“=”)。
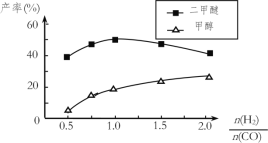
(5)在催化剂的作用下同时进行三个反应,发现随着起始投料比![]() 的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图的变化趋势。试解释投料比大于1.0之后二甲醚产率和甲醇产率变化的原因:_____。
的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图的变化趋势。试解释投料比大于1.0之后二甲醚产率和甲醇产率变化的原因:_____。