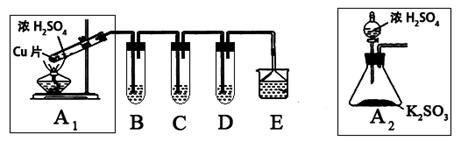
题目内容
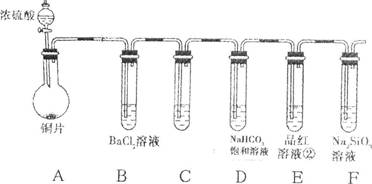
某学校兴趣小组设计如下装置进行实验探究(a、b为弹簧夹,加热及固定装置已略去)。
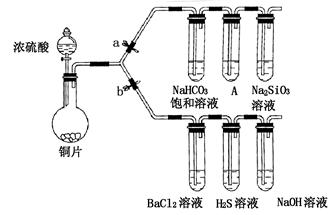
(1)验证碳、硅非金属性的相对强弱
①连接仪器、 、加药品后,打开a关闭b,然后滴入浓硫酸,加热;
②装置A中的试剂是 ;
③能说明碳的非金属性比硅强的实验现象是 。
(2)验证SO2的氧化性、还原性和酸性氧化物的通性
①打开b,关闭a。能验证SO2具有氧化性的化学方程式是 ;
②若过量的SO2通入NaOH溶液中,其离子方程式是 ;
③BaCl2溶液中无沉淀现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。
写出其中SO2显示还原性并生成沉淀的离子方程式 。

(1)验证碳、硅非金属性的相对强弱
①连接仪器、 、加药品后,打开a关闭b,然后滴入浓硫酸,加热;
②装置A中的试剂是 ;
③能说明碳的非金属性比硅强的实验现象是 。
(2)验证SO2的氧化性、还原性和酸性氧化物的通性
①打开b,关闭a。能验证SO2具有氧化性的化学方程式是 ;
②若过量的SO2通入NaOH溶液中,其离子方程式是 ;
③BaCl2溶液中无沉淀现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。
| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 | | |
写出其中SO2显示还原性并生成沉淀的离子方程式 。
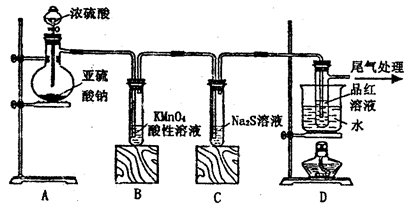
(1)①检验装置的气密性(1分)
②酸性KMnO4溶液(或品红溶液)(1分)
③A中酸性KMnO4溶液(或品红溶液)不退色,Na2SiO3溶液中出现白色沉淀(2分)
(2)①2H2S+SO2=3S↓+2H2O(2分)
②SO2+OH-=HSO3-(1分)
③
Ba2++SO2+Cl2+2H2O=BaSO4↓+4H++2Cl-(2分)
②酸性KMnO4溶液(或品红溶液)(1分)
③A中酸性KMnO4溶液(或品红溶液)不退色,Na2SiO3溶液中出现白色沉淀(2分)
(2)①2H2S+SO2=3S↓+2H2O(2分)
②SO2+OH-=HSO3-(1分)
③
| | | |
| | BaSO4 | BaSO3 |
试题分析:(1)①确保整个实验装置不能漏气,故要检验装置的气密性;②要除去二氧化硫对后面的干扰,故用酸性KMnO4溶液(或品红溶液)检验是否含有。③A中酸性KMnO4溶液(或品红溶液)不退色,Na2SiO3溶液中出现白色沉淀,由于发生的是复分解反应,较强酸可以生成较弱酸。(2)①证明二氧化硫的氧化性,硫的化合价要降低,故可以通过反应2H2S+SO2=3S↓+2H2O证实。②由于二氧化硫过量,故发生反应SO2+OH-=HSO3-。③氯水中的氯气有强的氧化性,能把二氧化硫氧化为硫酸,故反应为Ba2++SO2+Cl2+2H2O=BaSO4↓+4H++2Cl-。氨水呈碱性能和二氧化硫反生相当于酸碱中和反应,生成了亚硫酸根离子会和钡离子结合成BaSO3沉淀。

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目
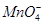 +□H2O=□
+□H2O=□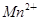 +□
+□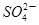 +□H+;
+□H+;