题目内容
在锌湿法冶炼过程中,会产生大量铜镉渣(主要含有Zn、Cd、Fe、Cu等),直接丢弃会造成环境污染,也是资源浪费,以下为回收处理铜镉渣制备硫酸锌晶体的工业流程:
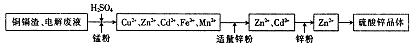
已知:硫酸锌晶体易溶于水,难溶于酒精。
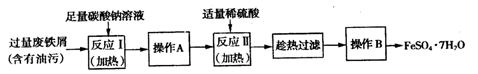
(1)加入硫酸的目的 。
(2)硫酸不能溶出铜,加入锰粉是为了结合铁离子的变价来传递电子,将铜溶出,锰粉的主要成分为MnO2,相关方程式为2Fe3++Cu=2Fe2++Cu2+和 。
(3)由硫酸锌溶液获得硫酸锌晶体,必要的操作方法为 。
(4)制得的硫酸锌晶体需要洗涤,选择的试剂为 ,原因是 。
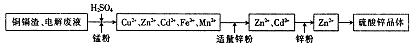
已知:硫酸锌晶体易溶于水,难溶于酒精。
(1)加入硫酸的目的 。
(2)硫酸不能溶出铜,加入锰粉是为了结合铁离子的变价来传递电子,将铜溶出,锰粉的主要成分为MnO2,相关方程式为2Fe3++Cu=2Fe2++Cu2+和 。
(3)由硫酸锌溶液获得硫酸锌晶体,必要的操作方法为 。
(4)制得的硫酸锌晶体需要洗涤,选择的试剂为 ,原因是 。
(10分)
(1)溶出铜镉渣中的Zn、Cd、Fe等金属(2分)
(2) MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O (3分)
(3)蒸发浓缩、冷却结晶、过滤(2分)
(4)酒精(1分)硫酸锌晶体易溶于水,水洗会造成硫酸锌晶体的损失(2分)
(1)溶出铜镉渣中的Zn、Cd、Fe等金属(2分)
(2) MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O (3分)
(3)蒸发浓缩、冷却结晶、过滤(2分)
(4)酒精(1分)硫酸锌晶体易溶于水,水洗会造成硫酸锌晶体的损失(2分)
试题分析:
(1)该工艺流程图中可以看出金属单质在硫酸的作用下转变为离子;
(2)根据工艺流程图中可以看出溶液中没有Fe2+,且MnO2转变为Mn2+,该反应为氧化还原反应MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
(3)从溶液中得到晶体的操作;
(4)结合题中信息,由于硫酸锌晶体易溶于水,难溶于酒精,应选择酒精洗涤。

练习册系列答案
相关题目
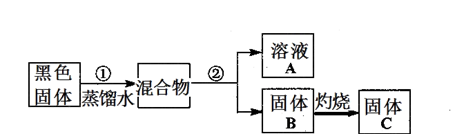
 +C2H5OH
+C2H5OH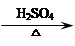
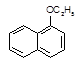 +H2O
+H2O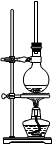
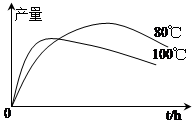
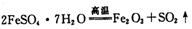
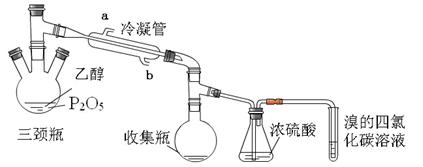
 。利用下图装置检验该反应的气体产物。
。利用下图装置检验该反应的气体产物。