题目内容
FeSO4·7H2O俗称绿矾,广泛用于医药和工监领域。
(1)已知FeSO4·7H2O晶体在加热条件下发生如下反应:
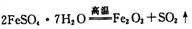
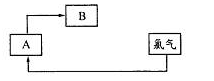
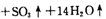 。利用下图装置检验该反应的气体产物。
。利用下图装置检验该反应的气体产物。
请填写下列空白:
①仪器的连接顺序为 (用a~i的字母表示)。
②装置C中的试剂X化学式为 ;该装置中冷水的作用是 。
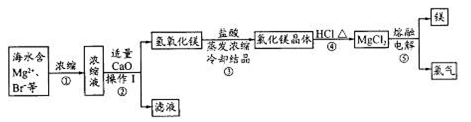
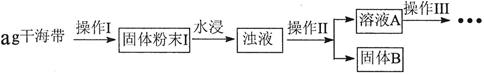
(2)以下是FeSO4·7H2O的实验窒制备流理图。

根据题意完成下列填空:
①反应Ⅱ需要l00mL l.5mol·L-1l的稀硫酸溶解洁净的铁屑,用质量分数为98%、密度为1.84g·cm-3的浓硫酸配制。所用的仪器有量筒、烧杯、玻璃捧、胶头滴管及 ,量取浓硫酸的体积为 。
②反应1需要加热数分钟,其原因是 ;操作A为 。
③测定FeSO4·7H2O产品中Fe2+含量的常用方法是KMnO4溶液滴定法。已知称取3.0g FeSO4·7H2O产品,配制成溶液,用硫酸酸化的0.01000moL·L-1 KMnO4溶液滴定,消耗KMnO4溶液的体积为200.00mL。发生反应的离子方程式为 ,计算上述样品中FeSO4·7H2O的质量分数为 (保留两位有效数字)。
(1)已知FeSO4·7H2O晶体在加热条件下发生如下反应:
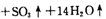 。利用下图装置检验该反应的气体产物。
。利用下图装置检验该反应的气体产物。
请填写下列空白:
①仪器的连接顺序为 (用a~i的字母表示)。
②装置C中的试剂X化学式为 ;该装置中冷水的作用是 。
(2)以下是FeSO4·7H2O的实验窒制备流理图。

根据题意完成下列填空:
①反应Ⅱ需要l00mL l.5mol·L-1l的稀硫酸溶解洁净的铁屑,用质量分数为98%、密度为1.84g·cm-3的浓硫酸配制。所用的仪器有量筒、烧杯、玻璃捧、胶头滴管及 ,量取浓硫酸的体积为 。
②反应1需要加热数分钟,其原因是 ;操作A为 。
③测定FeSO4·7H2O产品中Fe2+含量的常用方法是KMnO4溶液滴定法。已知称取3.0g FeSO4·7H2O产品,配制成溶液,用硫酸酸化的0.01000moL·L-1 KMnO4溶液滴定,消耗KMnO4溶液的体积为200.00mL。发生反应的离子方程式为 ,计算上述样品中FeSO4·7H2O的质量分数为 (保留两位有效数字)。
(15分)(1)①a、f、g、d、e、h、i、b(或a、g、f、d、e、h、i、b)(2分)
②BaCl2(2分) SO3与H2O的反应是放热反应,降低温度有利于SO3被水吸收(2分)
(2)①100ml容量瓶(1分)(只答容量瓶0分) 8.2ml(1分)
②升温促进Na2CO3水解,溶液碱性增强,去油污能力强(1分) 过滤、洗涤(2分)
③5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O(2分) 0.93(或93%)(2分)
②BaCl2(2分) SO3与H2O的反应是放热反应,降低温度有利于SO3被水吸收(2分)
(2)①100ml容量瓶(1分)(只答容量瓶0分) 8.2ml(1分)
②升温促进Na2CO3水解,溶液碱性增强,去油污能力强(1分) 过滤、洗涤(2分)
③5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O(2分) 0.93(或93%)(2分)
试题分析:(1)①检验水蒸气一般用无水硫酸铜,检验SO2一般用品红溶液。由于SO2的熔沸点较低,因此SO3气体易被水吸收生成硫酸,可以通过检验硫酸来检验SO3。又因为通过溶液时必然带出水蒸气,所以首先检验水蒸气,其次检验SO3,最后检验SO2,且还要有尾气吸收装置,因此正确的顺序是a、f、g、d、e、h、i、b(或a、g、f、d、e、h、i、b)。
②检验硫酸的试剂可以是氯化钡溶液。又因为SO3与H2O的反应是放热反应,所以装置中冷水的作用是降低温度,便于SO3被水吸收。
(2)①配制一定物质的量浓度溶液时,所用的仪器除了有量筒、烧杯、玻璃棒、胶头滴管以外,还必须有100ml容量瓶。稀释过程中溶质是不变的,所以需要浓硫酸的体积是V=
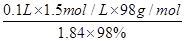 =8.2ml。
=8.2ml。②由于工业废铁屑中含有酯类油污,所以必须除去酯类油污。碳酸钠溶液显碱性,可以溶解酯类油污达到去除的目的。由于升高温度促进水解,溶液碱性增强,去油污能力增强,所以反应I需要加热数分钟。从溶液中分离铁的操作是过滤,然后洗涤即可,即操作A是过滤、洗涤。
③在反应中高锰酸钾是氧化剂,硫酸亚铁是还原剂,反应的离子方程式是5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O。所以根据方程式可知:
5FeSO4·7H2O~KMnO4
5mol 1mol
n 0.01000moL/L×0.200L
解得n=0.010mol
所以上述样品中FeSO4·7H2O的质量分数为
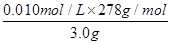 ×100%=93%
×100%=93%
练习册系列答案
相关题目
 形式存在
形式存在