题目内容
【题目】一种镁氧电池如图所示,电极材料为金属镁和吸附氧气的活性炭,电解液为KOH浓溶液。下列说法错误的是
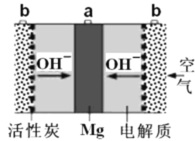
A.电池总反应式为:2Mg+O2+2H2O=2Mg(OH)2
B.负极反应式为:Mg-2e-+2OH- = Mg(OH)2
C.活性炭可以加快O2在负极上的反应速率
D.电子的移动方向由a经外电路到b
【答案】C
【解析】
该镁氧电池的负极为金属镁,正极为吸附氧气的活性炭,在电解液为KOH浓溶液条件下,负极镁失去电子变成镁离子,即电极反应方程式为Mg-2e- =Mg2+,溶液中有大量氢氧根,所以镁离子会结合氢氧根生成氢氧化镁;正极为氧气的电子转化为氢氧根,电极反应方程式为:O2+4e-+2H2O=4OH-;总电池反应方程式为:2Mg+O2+2H2O=2Mg(OH)2。
A.由分析可知,总电池反应方程式为:2Mg+O2+2H2O=2Mg(OH)2,故A正确;
B.由分析可知,负极电极反应方程式为:Mg-2e-+2OH- = Mg(OH)2,故B正确;
C.氧气在正极反应,所以活性炭可以加快O2在正极上的反应速率,故C错误;
D.根据原电池原理,电子从负极流出,经外电路流向正极,即电子由a经外电路到b,故D正确;
综上所述,答案为C。

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
【题目】下列实验装置能达到实验目的的是( )
|
|
|
|
A.测定一定时间内生成 H2的反应速率 | B.可以进行中和热的测定实验 | C.比较温度对化学反应速率的影响 | D.比较Cu2+、Fe3+对 H2O2分解速率的影响 |
A.AB.BC.CD.D