题目内容
4.丙烷燃烧电池,以KOH溶液为电解质溶液.(1)通入丙烷的电极为负极(填“正极”或“负极”),正极的电极反应式为O2+2H2O+4e-=4OH-.
(2)燃料电池的优点能量转换率高,反应产物对环境污染小的特点.
(3)若开始时电解质溶液中含KOH的物质的量为0.25mol,当溶液中K2CO3的物质的量为0.1mol时,消耗标准状况下丙烷的体积为746.7mL(保留一位小数)
分析 在燃料电池中,负极上是燃料发生失电子的氧化反应,在碱性环境下,电极反应为:C3H8+26OH--20e-=3CO32-+17H2O,正极上是氧气发生得电子得还原反应,电极反应为:O2+2H2O+4e-=4OH-,据此分析结合得失电子守恒计算.
解答 解:(1)在丙烷燃料电池中,负极上是燃料丙烷发生失电子的氧化反应,所以通入丙烷的电极为负极,正极上是氧气发生得电子得还原反应,电极反应为:O2+2H2O+4e-=4OH-,故答案为:负极;O2+2H2O+4e-=4OH-.
(2)燃料电池具有能量转换率高,反应产物对环境污染小的特点,故答案:能量转换率高,反应产物对环境污染小的特点;
(3)在燃料电池中,负极上是燃料发生失电子的氧化反应,在碱性环境下,电极反应为:C3H8+26OH--20e-=3CO32-+17H2O,所以当溶液中K2CO3的物质的量为0.1mol时,消耗标准状况下丙烷的体积为$\frac{0.1}{3}$×22.4×1000mL=746.7mL,故答案为:746.7.
点评 本题考查学生燃料电池的原理,注意电极反应方程式的书写是解题的关键,难度不大.

练习册系列答案
相关题目
14.关于下列各实验装置的叙述中,不正确的是( )
| A. | 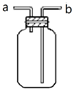 a口进气可收集CO2,b口进气可收集NH3 | |
| B. | 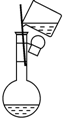 配制一定物质的量浓度溶液时,转移溶液 | |
| C. | 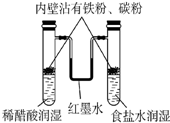 模拟铁锈蚀 | |
| D. | 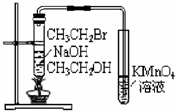 证明CH3CH2OH发生消去反应生成了乙烯 |
15.钋(Po)是周期表中的第84号元素,是居里夫在1898年发现的.钋-210属极毒放射性核素.据报道,最近俄罗斯的前特工利特维科的死亡与钋-210的毒害有关.对钋-210的叙述正确的是( )
| A. | 钋是一种银白色金属,能在黑暗中发光 | |
| B. | 钋的原子核内有210个中子 | |
| C. | 钋-210原子中中子数与核外电子数之差为126 | |
| D. | 钋-210的摩尔质量为210g |
16.标准状况下H2S和O2混合气体100mL,经点燃反应至完全,所得气体干燥后,恢复到原来状况时体积为10mL,该10mL气体可能是( )
| A. | H2S和SO2 | B. | O2和SO2 | C. | H2S或SO2 | D. | 只有SO2 |
17.下列叙述不正确的是( )
| A. | 焊锡(锡铅合金)熔点比金属锡高 | |
| B. | 生成物的能量与反应物的能量一般都不相等 | |
| C. | 使用催化剂,可加快反应速率,但不能改变反应限度 | |
| D. | 用CaSO4可降低盐碱地(含Na2CO3、NaCl)土壤的碱性 |
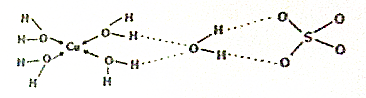

 、
、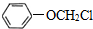 (写两种)
(写两种)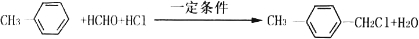 ,
,