题目内容
16.标准状况下H2S和O2混合气体100mL,经点燃反应至完全,所得气体干燥后,恢复到原来状况时体积为10mL,该10mL气体可能是( )| A. | H2S和SO2 | B. | O2和SO2 | C. | H2S或SO2 | D. | 只有SO2 |
分析 H2S和O2的混合气体点燃后充分反应,如氧气足量发生2H2S+3O2$\frac{\underline{\;点燃\;}}{\;}$2SO2+2H2O,剩余气体可能为SO2或二者都有;如氧气不足,发生2H2S+O2$\frac{\underline{\;点燃\;}}{\;}$2S+2H2O,剩余气体H2S,以此解答该题.
解答 解:①如氧气足量,则发生2H2S+3O2$\frac{\underline{\;点燃\;}}{\;}$2SO2+2H2O,
如剩余气体为O2和SO2或SO2,则H2S和O2共反应100mL-10mL=90mL,则反应的H2S体积为90mL×$\frac{2}{5}$=36mL,
则生成SO2的体积为36mL>10mL,不符合题意;
②若生成产物为SO2和S,则SO2为10ml,
则先后发生 2H2S+O2 $\frac{\underline{\;点燃\;}}{\;}$2S+2H2O
$\frac{2}{3}$×90ml $\frac{1}{3}$×90ml
S+O2 $\frac{\underline{\;点燃\;}}{\;}$SO2,
10ml 10ml
即H2S为60mL,O2为40mL,二者体积之和为100ml,符合题意;
③如剩余气体为H2S,则发生2H2S+O2$\frac{\underline{\;点燃\;}}{\;}$2S+2H2O,
H2S和O2共反应100mL-10mL=90mL,
则H2S为90mL×$\frac{2}{3}$+10mL=70mL,O2为90mL×$\frac{1}{3}$mL=30mL,二者体积之和为100ml,符合题意,
选项中C符合.
故选C.
点评 本题考查了混合物的计算,该题是基础性试题的考查,侧重对学生基础性知识的巩固和训练,有利于培养学生的规范答题能力,提高学生灵活运用基础知识解决实际问题的能力,难度中等.

Ⅰ.向第一份溶液中加入AgNO3溶液,有沉淀产生;
Ⅱ.向第二份溶液中加入足量NaOH溶液后加热,收集到气体0.04mol;
Ⅲ.向第三份溶液中加入足量BaCl2溶液,得到沉淀6.27g,经足量盐酸洗涤后,剩余沉淀质量为2.33g.根据上述实验中,以下推测正确的是( )
| A. | K+一定存在,且c(K+)≥0.2mol•L-1 | B. | 100mL溶液中含CO32-0.01mol | ||
| C. | K+不一定存在 | D. | Cl-一定存在 |
| A. | 甲烷 | B. | 乙烷 | C. | 丙烯 | D. | 苯 |
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 7种 |
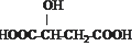
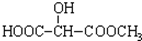 B.
B.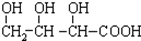 C.H3COOC-COOCH3
C.H3COOC-COOCH3 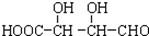 E.
E.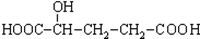
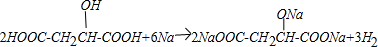 .
.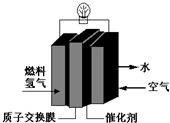 第29届奥运会期间,作为马拉松领跑车和电视拍摄车的汽车,装着“绿色心脏”--质子交换膜燃料电池,其工作原理如图所示.
第29届奥运会期间,作为马拉松领跑车和电视拍摄车的汽车,装着“绿色心脏”--质子交换膜燃料电池,其工作原理如图所示.