题目内容
亚硝酸(HNO2)是一种与醋酸酸性相当的弱酸,很不稳定,通常在室温下立即分解.(1)在酸性条件下,当NaNO2与KI按物质的量1:1恰好完全反应,且I-被氧化为I2时,产物中含氮的物质为
(2)要得到稳定的HNO2溶液,可以往冷冻的浓NaNO2溶液中加入或通入某种物质,下列物质不适合使用是
a.稀硫酸 b.二氧化碳 c.二氧化硫 d.磷酸
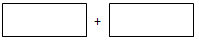
(3)工业废水中的NO2-可用铝粉除去.已知此反应体系中包含Al、NaAlO2、NaNO2、NaOH、NH3、H2O六种物质.将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中:
上述反应后废水的pH值将
(4)若工业废水中的NO2-的浓度约为1.0×10-4mol/L,取工业废水5mL于试管中,滴加2滴0.1mol/L的硝酸银溶液,能否看到沉淀现象?试通过计算说明.
(注:1mL溶液以20滴计;KSP(AgNO2)=2×10-8 mol2?L-2)
分析:(1)根据电子守恒以及原子守恒知识来回答;
(2)根据物质和亚硝酸钠溶液之间的反应情况来判断;
(3)亚硝酸钠具有氧化性,金属铝只有还原性,氧化还原反应中遵循电子守恒,以此来配平化学方程式;
(4)根据难溶电解质的溶度积常数表达式进行计算.
(2)根据物质和亚硝酸钠溶液之间的反应情况来判断;
(3)亚硝酸钠具有氧化性,金属铝只有还原性,氧化还原反应中遵循电子守恒,以此来配平化学方程式;
(4)根据难溶电解质的溶度积常数表达式进行计算.
解答:解:(1)碘离子被氧化为碘单质时,所有的碘元素化合价升高了2价,消耗碘离子是2mol,亚硝酸钠中氮元素化合价是+3价,2mol的亚硝酸钠得到2mol电子时,
则需氮元素的化合价降为+2价,
所以产物中含氮的物质为NO,故答案为:NO;
(2)浓NaNO2溶液中通入二氧化碳,会发生反应生成碳酸钠,在酸性条件下会发生化学反应,如果通入二氧化硫,会被亚硝酸氧化为硫酸,即二氧化硫具有还原性,
亚硝酸具有氧化性导致,故选bc;
(3)亚硝酸钠具有氧化性,金属铝只有还原性,发生的反应是亚硝酸钠和金属铝之间的反应,即Al+NaNO2+NaOH→NH3?H2O+NaAlO2,铝元素化合价从0价升高到+3价
,氮元素的化合价从+3降到-3价,
根据电子守恒,所以亚硝酸钠的系数是1,铝元素前面系数是2,反应消耗了氢氧化钠,所以溶液的PH会减小,
故答案为:NaNO2+2Al;减小;
(4)2滴溶液所消耗的亚硝酸钠:n(NO2-)=
mL×0.1mol/L=0.01 mmol,
则C(NO2-)?C(Ag +)=
mol/L×1.0×10-4 mol/L=2.0×10-7>KSP(AgNO2)=2×10-8 mol2?Lˉ2,则证明能看到有沉淀生成.
故答案为:2滴溶液中:n(NO2-)=
mL×0.1mol/L=0.01 mmol,则C(NO2-)?C(Ag +)=
mol/L×1.0×10-4 mol/L=2.0×10-7>KSP(AgNO2)=2×10-8 mol2?Lˉ2),则证明能看到有沉淀生成.
则需氮元素的化合价降为+2价,
所以产物中含氮的物质为NO,故答案为:NO;
(2)浓NaNO2溶液中通入二氧化碳,会发生反应生成碳酸钠,在酸性条件下会发生化学反应,如果通入二氧化硫,会被亚硝酸氧化为硫酸,即二氧化硫具有还原性,
亚硝酸具有氧化性导致,故选bc;
(3)亚硝酸钠具有氧化性,金属铝只有还原性,发生的反应是亚硝酸钠和金属铝之间的反应,即Al+NaNO2+NaOH→NH3?H2O+NaAlO2,铝元素化合价从0价升高到+3价
,氮元素的化合价从+3降到-3价,
根据电子守恒,所以亚硝酸钠的系数是1,铝元素前面系数是2,反应消耗了氢氧化钠,所以溶液的PH会减小,
故答案为:NaNO2+2Al;减小;
(4)2滴溶液所消耗的亚硝酸钠:n(NO2-)=
| 2 |
| 20 |
则C(NO2-)?C(Ag +)=
| 0.01 |
| 5 |
故答案为:2滴溶液中:n(NO2-)=
| 2 |
| 20 |
| 0.01 |
| 5 |
点评:本题是一道综合知识的考查题,要求学生具有知识的梳理和迁移能力,难度大,综合性强.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
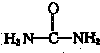 )与NO2-在酸性条件下反应生成两种无毒气体.该反应中生成16.8L(已折算为标准状况)混合气体时,消耗尿素的质量为
)与NO2-在酸性条件下反应生成两种无毒气体.该反应中生成16.8L(已折算为标准状况)混合气体时,消耗尿素的质量为