��Ŀ����
����Ŀ���ҹ�ӵ�зḻ�ĺ�����Դ����ˮ������ʷ�ƾã�����5000��ǰ�������Ļ�ʱ�ڣ����˾����ú�ˮ���Ρ�Ϊ��ȥ�����е�Ca2+��Mg2+��Fe3+��SO42-�Լ���ɳ�����ʣ�ijͬѧ�����һ���Ʊ����ε�ʵ�鷽�����������£����ڳ������Լ��Թ�������
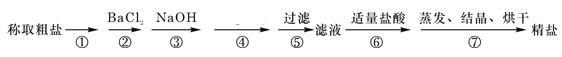
��1���ڢٲ������������� ���ڢڲ��ж�BaCl2�ѹ����ķ����� ��
��2���ڢܲ������Լ��Ļ�ѧʽΪ ��
��3���ڢݲ��������貣�������������� ��
��4�����ڢݲ����ڢ�˳��ߵ�������ʵ��������Ӱ�죬��ԭ���� ��
���𰸡���1���ܽ⣻ȡ�������е��ϲ���Һ���Թ��У������еμ��Ȼ�����Һ�����ް�ɫ�������ɣ���֤���Ȼ�����Һ�ѹ�������֮δ��������2��Na2CO3��3��©�����ձ�����������4�����в��ֳ�����CaCO3��BaCO3�ܽ⣬�Ӷ�Ӱ���Ƶþ��εĴ���
��������
�����������1������Ҫ�ܽ���ˮ�γ���Һ���ڢٲ��������������ܽ⣬�ڢڲ��μ�BaCl2��Ŀ���dz�ȥ��Һ���SO42-���������������а�ɫ�������ɣ���BaCl2�ѹ����ķ�����ȡ�������е��ϲ���Һ���Թ��У������еμ��Ȼ�����Һ�����ް�ɫ�������ɣ���֤���Ȼ�����Һ�ѹ�������֮δ������
��2�������ڢ۶�������Һ��ʣ���Ca2+��������Ba2+��Ҫ��ȥ����ڢܲ������Լ��Ļ�ѧʽΪNa2CO3��
��3���ڢݲ����˲������貣��������������©�����ձ�����������
��4���ڢ�ʵ���Ŀ���ǵμ�ϡ�����ȥ��Һ�������OH����CO32�������ڢݲ����ڢ�˳��ߵ������в��ֳ�����CaCO3��BaCO3�������ܽ⣬�Ӷ�Ӱ���Ƶþ��εĴ��ȡ�

 ������ʱͬ����ϰ��ϵ�д�
������ʱͬ����ϰ��ϵ�д�