题目内容
某化学学习小组同学根据实验室现有的制取氨气的药品,设计了右图所示的实验装置(部分夹持仪器未画出),制取并探究氨气的还原性、检验反应产物。请回答下列问题:
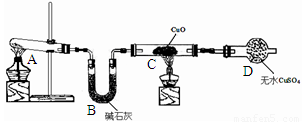
(1)A中发生反应的化学方程式是 。
(2)B中碱石灰的作用是 。
(3)C中黑色固体变红,且产生的气体对空气无污染,写出该反应的化学方程式 ;
D中发生的现象是________________________________________________________________________。
(4)该装置存在明显缺陷,该缺陷是 。
(5)工业中常用氮气与氢气在高温、高压、铁触媒做催化剂的条件下合成氨气,该小组同学模拟该条件也合成出了氨气。已知起始时,将2 mol N2、6 mol H2充入一个容积为2 L的密闭容器中发生反应,过了5 min后,混合气体的总物质的量减少了1 mol,求在这段时间内以H2表示的化学反应速率
为 。
(1)Ca(OH)2+2NH4Cl CaCl2+2NH3↑+2H2O(2分);
CaCl2+2NH3↑+2H2O(2分);
(2)干燥氨气(1分);
(3)3CuO+2NH3  3Cu+N2+3H2O(2分);无水硫酸铜变蓝(1分);
3Cu+N2+3H2O(2分);无水硫酸铜变蓝(1分);
(4)缺少尾气处理装置(1分);
(5)0.15 mol/(L·min)(2分)
【解析】
试题分析:(1)装置A是制备氨气的,因此其中发生反应的化学方程式是Ca(OH)2+2NH4Cl CaCl2+2NH3↑+2H2O。
CaCl2+2NH3↑+2H2O。
(2)由于生成的氨气中混有水蒸气,会干扰后续实验中产物水的测定,碱石灰是干燥剂能吸收水蒸气,所以碱石灰的作用是干燥氨气,防止干扰产物水的测定。
(3)黑色CuO变为红色,所以生成物是铜;同时生成一种无色气体,该气体无污染,因此该气体是氮气。根据原子守恒可知,还有水生成,则反应的化学方程式为3CuO+2NH3  3Cu+N2+3H2O。无水硫酸铜易吸水由摆手舞变为蓝色,所以D中的实验现象是白色无水CuSO4粉末变为蓝色。
3Cu+N2+3H2O。无水硫酸铜易吸水由摆手舞变为蓝色,所以D中的实验现象是白色无水CuSO4粉末变为蓝色。
(4)氨气是刺激性气体,所以不能随意排放到空气中,应有尾气处理装置,可用如图所示装置吸收氨气 。
。
(5)合成氨反应的化学方程式为:
3H2 +
N2 2NH3
△n↙
2NH3
△n↙
3mol 1mol 2mol 2mol
n(H2) 1mol
解得n(H2)= =1.5mol
=1.5mol
则消耗氢气的浓度是1.5mol÷2L=0.75mol/L
因此在这段时间内以H2表示的化学反应速率=0.75mol/L÷5min=0.15 mol/(L·min)
考点:考查氨气的制备、气体除杂、性质探究、尾气处理以及反应速率的计算等

 名校课堂系列答案
名校课堂系列答案
 这样便得到了高纯度的纳米铁粉.
这样便得到了高纯度的纳米铁粉. Fe+2CO2↑+2H2O↑
Fe+2CO2↑+2H2O↑