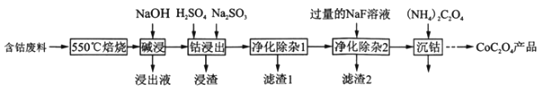
题目内容
【题目】“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
___ C+ ___ KMnO4+ H2SO4 = ____CO2↑+ ____MnSO4 + ____K2SO4+
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下二组数据:
CO2(g)+H2(g),得到如下二组数据:
实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
CO | H2O | H2 | CO | |||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
①实验1中以CO2表示的化学反应速率为__________(保留小数点后二位数,下同)。
②实验2条件下平衡常数K=_________,该反应为 _____(填“吸”或“放”)热反应。
(3)已知在常温常压下:
① 2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g) ΔH = -1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH = -566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式:_____________。
(4)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。
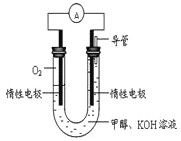
①该电池负极的电极反应为:_______________。
②该电池工作时,溶液中的OH-向______极移动。
【答案】 5 C + 4KMnO4 + 6 H2SO4 = 5CO2↑+ 4MnSO4 + 2K2SO4+ 6H2O 0.13mol/(L·min) 0.17 放 CH3OH(l)+O2(g)=CO(g)+2H2O(g)ΔH=-354.8KJ/mol CH3OH+8OH— —6e-=CO32-+6 H2O 负
【解析】(1)由反应方程式可知,C元素从0价升高为+4价,Mn元素从+7价降低为+2价,所以最小公倍数为20,则配平后的方程式为 5 C + 4KMnO4 + 6 H2SO4 = 5CO2↑+ 4MnSO4 + 2K2SO4+ 6H2O;
(2)①由表中实验1的数据,结合反应方程式可知,n(CO2)起始=0,平衡时n(CO2)平衡=n(H2)平衡=1.6mol,则以CO2表示的化学反应速率为=![]() = 1.3(L·min);②实验2中各物质的平衡浓度为c(CO2)平衡=c(H2)平衡=0.2mol/L,c(CO)平衡=0.8mol/L,c(H2O)平衡=0.3mol/L,则K2=
= 1.3(L·min);②实验2中各物质的平衡浓度为c(CO2)平衡=c(H2)平衡=0.2mol/L,c(CO)平衡=0.8mol/L,c(H2O)平衡=0.3mol/L,则K2= ![]() =
=![]() = 0.17;同理求出实验1的K1 = 2.7,可见,当温度升高时,平衡常数K值减小,即平衡向左移动,则该反应为放热反应;
= 0.17;同理求出实验1的K1 = 2.7,可见,当温度升高时,平衡常数K值减小,即平衡向左移动,则该反应为放热反应;
(3)根据要求甲醇不完全燃烧生成一氧化碳和水的化学方程式为CH3OH+O2=CO +2H2O,根据盖斯定律(①—②)/2 可得CH3OH(l)+O2(g)=CO(g) +2H2O(g) ΔH=-354.8KJ/mol;
(4)该装置的原理实质就是甲醇在碱性条件下的燃烧,反应的离子方程式为2CH3OH+3O2+4OH-![]() 2CO32-+6H2O,所以通氧气的一极为正极,其电极反应式为O2+2H2O+4e-=4OH-,则甲醇在负极反应,其电极反应式为CH3OH+8OH— —6e-=CO32-+6 H2O;根据原电池工作原理,在电解质溶液中,阴离子向负极移动,所以溶液中的OH-向负极即甲醇的一极移动。
2CO32-+6H2O,所以通氧气的一极为正极,其电极反应式为O2+2H2O+4e-=4OH-,则甲醇在负极反应,其电极反应式为CH3OH+8OH— —6e-=CO32-+6 H2O;根据原电池工作原理,在电解质溶液中,阴离子向负极移动,所以溶液中的OH-向负极即甲醇的一极移动。

【题目】工业上常用乙炔燃烧产生的高温火焰来切割金属。若用R表示乙炔,其燃烧的化学方程式为:2R+3O2=4CO2+2H2O,则乙炔的化学式是( )
A.C2H4B.C2H2C.CH3COOHD.C2H6
【题目】第四周期过渡元素常与H2O、NH3等形成配合物。
(1)写出Fe元素基态原子的价层电子排布式_______;
(2)C、N、O元素的第一电离能从大到小的顺序为___(用元素符号表示);
(3)向盛有硫酸铜水溶液的试管里加入过量氨水,得到蓝色溶液,铜离子形成了配位数为4的配离子,写出该配离子的结构式为______。
(4)由C、H、O、S中任两种元素构成甲、乙、丙三种分子,所含原子的数目依次为3、4、8,都含有18个电子。甲和乙的主要物理性质比较如下:
熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
甲 | 187 | 202 | 2.6 |
乙 | 272 | 423 | 以任意比互溶 |
①甲分子的电子式为_________,分子构型为___________;
②1 mol乙分子含有___个σ键;
③丙分子的中心原子采取_______杂化轨道;
④甲和乙的相对分子质量基本相同,造成上述物理性质差异的主要原因是 ____________(结合具体物质解释)。