题目内容
(14分)
工业合成氨反应:N2+3H2 2NH3,在一定条件下已达到平衡状态。
2NH3,在一定条件下已达到平衡状态。
(1)若降低温度,会使上述平衡向生成氨的方向移动,生成每摩尔氨的反应热数值是46.2KJ/mol,则该反应的热化学方程式为 。
(2)若在恒温条件下,将N2与H2按一定比例混合的气体通入一个容积为2升固定容积的密闭容器中,5分钟后反应达平衡时,n(N2)="1.2mol," n(H2)="1.2mol," n (NH3)=0.8mol,则反应速率V(N2)= mol·L-1·min-1,H2的转化率= ,平衡常数= 。若保持容器的温度和容积不变,将上述平衡体系中的混合气体的浓度增大1倍,则平衡 (填向左﹑向右或不移动)移动。
(3)若在恒温恒压条件下,将1 molN2与3 molH2的混合气体通入一个容积可变的容器中发生反应,达平衡后,生成a molNH3,这时N2的物质的量为 mol,(用含a的代数式表示);若开始时只通入N2与H2,达平衡时生成3amolNH3,则开始时应通入N2 3mol,H2 = mol(平衡时NH3的质量分数与前者相同);若开始时通入x molN2﹑6molH2和2mol NH3,达平衡后,N2和NH3的物质的量分别为y mol和3a mol,则x= mol,y= mol(用含a的代数式表示)
(14分)
(1) N2(g) +3H2(g) 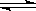 2NH3(g),△H=-92.4KJ·mol-1
2NH3(g),△H=-92.4KJ·mol-1
(2) 0.04 50% 1.23 向右
(3) 1-a/2 9 2 3-3a/2
解析

 阅读快车系列答案
阅读快车系列答案 2NH3,在一定条件下已达到平衡状态.
2NH3,在一定条件下已达到平衡状态. 2NH3 ,在一定条件下已达到平衡状态。
2NH3 ,在一定条件下已达到平衡状态。