题目内容
16.恒温、恒压下,1molA和1molB在一个容积可变的容器中发生如下反应:A(g)+2B(g)?2C(g).一段时间后达到平衡,生成amolC.则下列说法不正确的是( )| A. | 物质A、B的转化率之比一定是1:2 | |
| B. | 起始时刻和达平衡后容器中的压强比为1:1 | |
| C. | 若起始放入3molA和3molB,则达平衡时生成3amolC | |
| D. | 当v正(A)=v逆(C)时,可断定反应达到平衡 |
分析 A.A、B的起始量都是1mol,所以A、B的转化率之比等于参加反应的物质的物质的量之比;
B.根据题中条件,反应恒温、恒压下进行,据此判断;
C.在恒压下,放入3molA和3nmolB,与起始时1molA和nmolB配比数相等,为等效平衡;
D.反应达平衡时,正逆反应速率相等,根据速率之比等于化学计量数之比判断.
解答 解:A.A、B的起始量都是1mol,所以A、B的转化率之比等于参加反应的物质的物质的量之比,根据反应方程式可知,物质A、B的转化率之比一定是1:2,故A正确;
B.根据题中条件,反应恒温、恒压下进行,所以起始时刻和达平衡后容器中的压强比为1:1,故B正确;
C.在恒压下,放入3molA和3nmolB,与起始时1molA和nmolB配比数相等,为等效平衡,则达平衡时生成3amolC,故C正确;
D.当2v正(A)=v逆(C)时,正逆反应速率相等,反应达到平衡状态,故D错误.
故选D.
点评 本题考查化学平衡中平衡标志的判断,转化率、及等效平衡问题,题目难度不大,注意反应在恒压条件下进行的状态.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
2.下列说法错误的是( )
| A. | BeF2分子中,中心原子Be的价层电子对数为2,σ键电子对数也等于2,空间构型为直线形 | |
| B. | SF2分子中,中心原子S的价层电子对数等于4,其VSEPR模型为四面体,分子立体构型为V形 | |
| C. | BF3分子的立体构型为平面正三角形 | |
| D. | CO32-离子的中心原子采取sp3杂化 |
7.某温度下,H2 (g)+CO2(g)?H2O(g)+CO(g)的平衡常数K=2.25.该温度下在甲、乙、丙三个恒容密闭容器中,投入H2 (g)和C02 (g),其起始浓度如表所示:
下列判断不正确的是( )
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)mol/L | 0.010 | 0.020 | 0.020 |
| c(CO2)mol/L | 0.010 | 0.010 | 0.020 |
| A. | 平衡时,甲中和丙中H2的转化率均是60% | |
| B. | 平衡时,丙中c(CO2)是0.012 mol/L | |
| C. | 平衡时,乙中CO2的转化率大于60% | |
| D. | 反应开始时,丙中的反应速率最快,甲中的反应速率最慢 |
4.催化剂能加快反应速率,下面关于催化剂的说法正确的是( )
| A. | 催化剂只改变正反应速率的速率 | |
| B. | 催化剂能够改变反应的反应热 | |
| C. | 催化剂能改变反应物的转化率 | |
| D. | 催化剂通过降低反应的活化能来加快反应速率 |
11.阱(N 2H4)常用于火箭或原电池的燃料.己知:
①N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ•mol
③H2O(g)=H2O(1)△H=-44kJ/mol
(1)2N2H4(g)+2NO2(g)=3N2(g)+4H2O(1)△H=-1311.7kJ.mol-1
(2)一定温度下,将N2H4与N02以体积比1:1置于10L密闭容器中发生反应:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(1)
下列不能说明反应达到平衡状态的是ac.(填序号)
a.混合气体密度保持不变 b.混合气体颜色保持不变
c.N2H4比与NO2体积比保持不变 d.体系压强保持不变
(3)在10L的密闭容器中发生上述反应,容器内部分物质的物质的量变化如下表:
前2min内NO2的平均反应速率为0.01mol/(L•min).平衡时N02的转化率25%;(2)中反应平衡常数表达式为K=$\frac{{c}^{3}({N}_{2})}{{c}^{2}({N}_{2}{H}_{4})•{c}^{2}(N{O}_{2})}$,计算该温度下反应的平衡常数K=0.9375.反应在第6min时改变了条件,改变的条件可能是bc(填序号)a.使用催化剂b.升高温度c.扩大容器容积d.增加N02的量
(4)若在一定温度下,(2)中反应的平衡常数为20,反应到某时刻测得N2H4、NO2、N2的溶度均为0.1mol.L-1,此时v正>v逆.
①N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ•mol
③H2O(g)=H2O(1)△H=-44kJ/mol
(1)2N2H4(g)+2NO2(g)=3N2(g)+4H2O(1)△H=-1311.7kJ.mol-1
(2)一定温度下,将N2H4与N02以体积比1:1置于10L密闭容器中发生反应:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(1)
下列不能说明反应达到平衡状态的是ac.(填序号)
a.混合气体密度保持不变 b.混合气体颜色保持不变
c.N2H4比与NO2体积比保持不变 d.体系压强保持不变
(3)在10L的密闭容器中发生上述反应,容器内部分物质的物质的量变化如下表:
| 物质的量/时间 | n(N2H4) | n(NO2) | n(N2) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.3 |
| 第5min | 0.4 | 1.2 | 0.6 |
| 第6min | 0.4 | 1.2 | 0.6 |
| 第10min | 0.6 | 1.4 | 0.3 |
(4)若在一定温度下,(2)中反应的平衡常数为20,反应到某时刻测得N2H4、NO2、N2的溶度均为0.1mol.L-1,此时v正>v逆.
1.己知N2O4(g)?2NO2(g)△H=+57.20KJ•mol-1,t时,将一定量的NO2、N2O4,充入一个容器为2L的恒容密闭容器中,浓度随时间变化关系如下表所示:
①c( X)代表NO2(填化学式)的浓度,该反应的平衡常数K=0.9.(填具体数值)
②前10min内用NO2表示的反应速率为,20min时改变的条件是;重新达到平衡时,NO2的百分含量b(填选项前字母).
a.增大 b.减小 c.不变 d.无法判断.
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| c(X)/(mol/L) | 0.2 | c | 0.6 | 0.6 | 1.0 | c1 | c1 |
| c(Y)/(mol/L) | 0.6 | c | 0.4 | 0.4 | 0.4 | c2 | c2 |
②前10min内用NO2表示的反应速率为,20min时改变的条件是;重新达到平衡时,NO2的百分含量b(填选项前字母).
a.增大 b.减小 c.不变 d.无法判断.
8.化学工业与人类的生产生活息息相关,回答下列问题:
(1)已知反应:Fe(s)+CO2(g)?FeO(s)+CO(g)△H=a kJ?mol-1,平衡常数为K;
测得在不同温度下,K值如下:
①写出K的表达式$\frac{[CO]}{[CO2]}$.
②反应中的a大于0(填“大于”、“小于”或“等于”).
③若500℃时进行反应,CO2起始浓度为2mol?L-1,CO的平衡浓度为1mol?L-1.
④700℃反应达到平衡,此时增大反应中CO的浓度,该平衡移动后达到新的平衡,其它条件不变时,CO 和CO2的体积比值不变(填“增大”、“减小”或“不变”).
(2)工业固氮反应是:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol.在相同温度下,体积均为0.25L的两个恒容密闭容器中可发生上述可逆反应,测得反应的有关数据如表:
①容器a达平衡时N2的平衡浓度c(N2)=3mol?L-1.
②容器b达平衡时NH3的平衡浓度c(NH3)=2mol?L-1.
③下列叙述正确的是AB.
A.容器a达平衡时NH3的物质的量是0.5mol
B.容器b开始是向合成氨的逆反应方向进行
C.若容器a体积变为0.2L,则达平衡时放出的热量小于23.1kJ
D.不能利用已知数据计算容器b的平衡常数.
(1)已知反应:Fe(s)+CO2(g)?FeO(s)+CO(g)△H=a kJ?mol-1,平衡常数为K;
测得在不同温度下,K值如下:
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
②反应中的a大于0(填“大于”、“小于”或“等于”).
③若500℃时进行反应,CO2起始浓度为2mol?L-1,CO的平衡浓度为1mol?L-1.
④700℃反应达到平衡,此时增大反应中CO的浓度,该平衡移动后达到新的平衡,其它条件不变时,CO 和CO2的体积比值不变(填“增大”、“减小”或“不变”).
(2)工业固氮反应是:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol.在相同温度下,体积均为0.25L的两个恒容密闭容器中可发生上述可逆反应,测得反应的有关数据如表:
| 容器 编号 | 起始时各物质物质的量/mol | 达平衡时体系的 能量变化 | ||
| N2 | H2 | NH3 | ||
| a | 1 | 3 | 0 | 放热23.1kJ |
| b | 0.6 | 1.8 | 0.8 | 吸热Q kJ |
②容器b达平衡时NH3的平衡浓度c(NH3)=2mol?L-1.
③下列叙述正确的是AB.
A.容器a达平衡时NH3的物质的量是0.5mol
B.容器b开始是向合成氨的逆反应方向进行
C.若容器a体积变为0.2L,则达平衡时放出的热量小于23.1kJ
D.不能利用已知数据计算容器b的平衡常数.
5.下列说法正确的是( )
| A. | 原子晶体中只存在非极性共价键 | |
| B. | 干冰升华时,分子内共价键不会发生断裂 | |
| C. | 因为HCl的相对分子质量大于HF,所以HCl的沸点高于HF | |
| D. | 金属元素和非金属元素形成的化合物一定是离子化合物 |
6.下列有关化学实验操作正确的是( )
| A. | 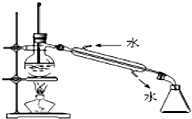 蒸馏 | B. |  过滤 | ||
| C. | 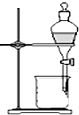 萃取 | D. | 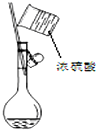 移液 |