题目内容
【题目】在容积为1.0 L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
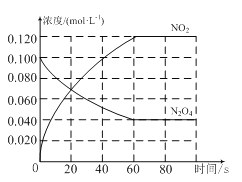
(1)反应的ΔH________0(填“大于”或“小于”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60 s时段,反应速率v(N2O4)为_______mol·L-1·s-1;反应的平衡常数K1为________。
(2)100 ℃时达平衡后,改变反应温度为T,c(N2O4)以0.0020mol·L-1·s-1的平均速率降低,经10 s又达到平衡。
①T________100 ℃(填“大于”或“小于”),判断理由是____________________。
②列式计算温度T时反应的平衡常数K2:________________________。
(3)温度T时反应达平衡后,将反应容器的容积缩小到一半,平衡向________(填“正反应”或“逆反应”)方向移动,再次达到平衡后,NO2的浓度 (填“增大”或“缩小”)。
【答案】(1)大于 0.001 0 0.36 mol·L-1
(2)①大于 反应正方向吸热,反应向吸热方向进行,故温度升高
②平衡时,c(NO2)=0.120mol·L-1+0.0020mol·L-1·s-1×10s×2=0.160mol·L-1
c(N2O4)=0.040mol·L-1-0.0020mol·L-1·s-1×10s=0.020mol·L-1
K2=![]() =1.28mol·L-1
=1.28mol·L-1
(3)逆反应 增大
【解析】
试题分析:(1)温度升高,混合气体的颜色变深,说明升高温度,平衡向生成二氧化氮的方向移动,所以平衡正向移动,则正向是吸热反应,ΔH>0;在0~60s时段,N2O4的物质的量浓度从0.100mol/L减少到0.040mol/L,所以反应速率v(N2O4)=(0.100-0.040)mol/L/60s=0.001 mol·L-1·s-1;平衡时c(N2O4)=0.040mol/L,c(NO2)=0.120mol/L,所以100℃的平衡常数K=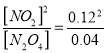 =0.36 mol·L-1;
=0.36 mol·L-1;
(2)①c(N2O4)以0.002 0 mol·L-1·s-1的平均速率降低,说明平衡正向移动,则温度升高,T>100℃;因为正反应是吸热反应,温度升高,平衡才向正向移动;
②c(N2O4)以0.002 0 mol·L-1·s-1的平均速率降低,经10 s又达到平衡,则10s后达到平衡时的c(N2O4)=0.040mol/L-0.0020mol·L-1·s-1×10s=0.02mol/L,则此时c(NO2)=0.120mol/L+2×0.02mol/L=0.16mol/L,所以T温度的平衡常数K=![]() =1.28mol·L-1。
=1.28mol·L-1。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,则压强增大,平衡逆向移动,因为增大压强,平衡向气体物质的量减少的方向移动,而逆向是气体的物质的量减少的方向,所以平衡逆向移动。

 阅读快车系列答案
阅读快车系列答案