题目内容
【题目】某强酸性溶液X含有Ba2+、Al3+、NH+4、Fe2+、Fe3+、CO2-3、SO2-3、SO2-4、Cl-、NO-3中的一种或几种,取该溶液进行连续实验,实验内容如下:
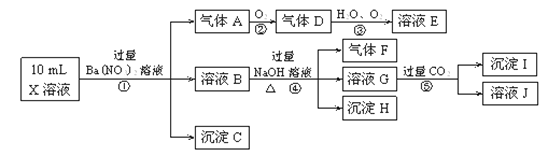
根据以上信息,回答下列问题:
(1)反应③的化学方程式为________________________。
(2)沉淀C、H和气体F的化学式分别为____________________。
(3)写出有关反应的离子方程式:
①中生成A_____________________。⑤________________________。
(4)上述离子中,溶液X中肯定不含有的离子是_______________,可能含有的离子是___________。
【答案】
(1)4NO2+O2+2H2O=4HNO3;
(2)BaSO4、Fe(OH)3、NH3;
(3)3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)NO3-、Ba2+、CO32-、SO32-;Cl-、Fe3+。
【解析】
试题分析:在强酸性溶液中一定不会存在CO32-和SO32-离子,加入过量硝酸钡生成沉淀,则该沉淀为BaSO4沉淀,说明溶液中含有SO42-离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子,溶液B中加入过量NaOH溶液,沉淀H为Fe(OH)3,生成气体F,则F为NH3,说明溶液中含有NH4+离子,溶液G中通入CO2气体,生成沉淀I,则I为Al(OH)3,G为NaOH和NaAlO2,说明溶液中含有Al3+离子,溶液中含有Fe2+离子,就一定不含NO3-离子,含有SO42-离子就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl-。
(1)由以上推断可知,D为NO2,E为HNO3,反应③的化学方程式为:4NO2+O2+2H2O=4HNO3,故答案为:4NO2+O2+2H2O=4HNO3;
(2)由以上推断可知,沉淀C为BaSO4沉淀,沉淀H为Fe(OH)3,气体F为NH3,故答案为:BaSO4、Fe(OH)3、NH3;
(3)①Fe2+离子被氧化为Fe3+离子,NO3-离子被还原为NO气体,反应的离子方程式为3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,故答案为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
②G为NaOH和NaAlO2混合物,通入过量二氧化碳后分别发生的反应为:CO2+OH-=HCO3-,AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
(4)通过以上分析可知,X中肯定含有:Al3+、NH4+、Fe2+、SO42-;可能含有Fe3+、Cl-;一定没有:Ba2+、CO32-、SO32-、NO3-;故答案为:Ba2+、CO32-、SO32-、NO3-;Fe3+、Cl-。