题目内容
(11分)某同学按下列步骤配制500 mL 0.2 mol·L-1 KCl溶液,请回答下列问题:
你认为按上述步骤配制的KCl溶液的浓度是否为0.2 mol·L-1,请说明理由。
| 实验步骤 | 有关问题 |
| (1)计算所需KCl的质量 | 需要KCl的质量为______g |
| (2)称量KCl固体 | 称量过程中主要用到的仪器有________________ |
| (3)将KCl放入到100 mL烧杯中加水溶解 | 为加快溶解速度,可采取的措施是______________________ |
| (4)将烧杯中的溶液转移至500 mL容量瓶中 | 为防止溶液溅出,应采取的措施是____________________ |
| (5)向容量瓶中加蒸馏水到刻度线 | 在进行此操作时应注意的问题是__________________________ |
| 实验步骤 | 有关问题 |
| (1) | 7.45 |
| (2) | 天平、药匙 |
| (3) | 称前研细,溶解时搅拌或加热 |
| (4) | 玻璃棒引流 |
| (5) | 用玻璃棒引流,加入蒸馏水至离刻度线1~2_cm处,改用胶头滴管滴加至刻度线 |
根据配制一定物质的量浓度溶液的步骤:
(1)n(KCl)=0.5 L×0.2 mol·L-1=0.1 mol
m(KCl)=74.5 g·mol-1×0.1 mol=7.45 g
(2)称KCl固体质量,所用仪器:天平、药匙。
(3)为加快溶解,可称前研细,溶解时搅拌或加热。
(4)为了防止移液时液体溅出,可采用玻璃棒引流。
(5)加蒸馏水时,用玻璃棒引流,加入蒸馏水至离刻度线1~2 cm处,改用胶头滴管滴加至刻度线。由于移液时未洗涤烧杯和玻璃棒,配制溶液的浓度低于0.2 mol·L-1。
(1)n(KCl)=0.5 L×0.2 mol·L-1=0.1 mol
m(KCl)=74.5 g·mol-1×0.1 mol=7.45 g
(2)称KCl固体质量,所用仪器:天平、药匙。
(3)为加快溶解,可称前研细,溶解时搅拌或加热。
(4)为了防止移液时液体溅出,可采用玻璃棒引流。
(5)加蒸馏水时,用玻璃棒引流,加入蒸馏水至离刻度线1~2 cm处,改用胶头滴管滴加至刻度线。由于移液时未洗涤烧杯和玻璃棒,配制溶液的浓度低于0.2 mol·L-1。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
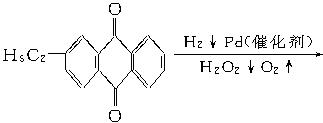
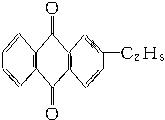

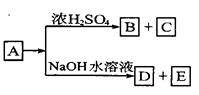
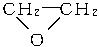 +CaCl2+H2O,则制备
+CaCl2+H2O,则制备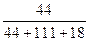 ×100%。在绿色化学工艺中,原子的利用率为100%的工艺称理想状态的“绿色工艺”。本题提供的生成H2O2的方法,可否称为理想状态的“绿色工艺”?简述理由。
×100%。在绿色化学工艺中,原子的利用率为100%的工艺称理想状态的“绿色工艺”。本题提供的生成H2O2的方法,可否称为理想状态的“绿色工艺”?简述理由。
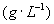 分别表示溶质在A、B两种溶剂中的浓度,则有c(A)/c(B)=K。对于
分别表示溶质在A、B两种溶剂中的浓度,则有c(A)/c(B)=K。对于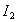 而言,
而言,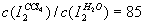 。现有2.0L碘水,其中含
。现有2.0L碘水,其中含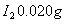 ,若用
,若用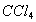 萃取,按两种方法萃取:第一种方法用50mL
萃取,按两种方法萃取:第一种方法用50mL