题目内容
【题目】取软锰矿石(主要成分为MnO2)116 g跟足量浓盐酸发生如下反应(杂质不参与反应)MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,制得22.4 L Cl2(标准状况),下列有关说法中不正确的是
MnCl2+Cl2↑+2H2O,制得22.4 L Cl2(标准状况),下列有关说法中不正确的是
A.这种软锰矿石中MnO2的质量分数为75%
B.被氧化的HCl的物质的量为4 mol
C.参加反应的HCl的质量为146 g
D.被还原的MnO2的物质的量为1 mol
【答案】B
【解析】
先计算氯气的物质的量,然后根据方程式中物质反应转化关系计算物质的作用及反应的物质的量或质量。
A.n(Cl2)=![]() =1mol,由MnO2+4HCl(浓)
=1mol,由MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O反应方程式可知:反应产生1molCl2,有1molMnO2参加反应,其质量为87g,则软锰矿石中MnO2的质量分数为
MnCl2+Cl2↑+2H2O反应方程式可知:反应产生1molCl2,有1molMnO2参加反应,其质量为87g,则软锰矿石中MnO2的质量分数为![]() ×100%=75%,A正确;
×100%=75%,A正确;
B.由反应可知,生成1molCl2气体时,2molHCl被氧化,B错误;
C.参加反应的HCl为4mol,其质量m(HCl)=4mol×36.5g/mol=146g,C正确;
D.在该反应中,Mn元素的化合价降低,被还原的MnO2的物质的量为1mol,D正确;
故合理选项是B。

【题目】甘氨酸亚铁[(NH2CH2COO)2Fe]是一种补铁强化剂。某学习小组利用FeCO3与甘氨酸(NH2CH2COOH)制备甘氨酸亚铁,实验装置如下图所示(夹持和加热仪器已省略)。
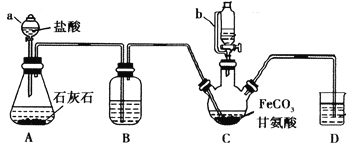
有关物质性质如下表:
甘氨酸 | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇 | 易溶于水和乙醇 | 易溶于水,难溶于乙醇 |
两性化合物 | 强酸性、强还原性 |
实验过程:
I.合成:装置C中盛有0.1mol FeCO3和200mL1.0mol·L-1甘氨酸溶液和适量柠檬酸。实验时,先打开仪器a的活塞,待装置c中空气排净后,加热并不断搅拌,并通过仪器b向C中加入适量氢氧化钠溶液调节pH到6左右,使反应物充分反应。
Ⅱ.分离:反应结束后,过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
回答下列问题:
(1)仪器a的名称是________;与a相比,仪器b的优点是_____________________________。
(2)装置B中盛有的试剂是____________;实验过程中装置D的导管一直没入液面下的必要性是___________________________________________。
(3)合成过程加入柠檬酸的作用是促进FeCO3溶解和________________________ 。
(4)加入氢氧化钠溶液调节pH若大于6,甘氨酸亚铁产量下降。原因可用离子方程式表示为________。
(5)过程II中加入无水乙醇的目的是_______________________。
(6)检验产品中是否含有Fe3+的试剂名称是_________ 。
(7)本实验制得15.3g甘氨酸亚铁(M=204g/mol),则其产率是_____%。
【题目】某化学实验小组用酸性 KMnO4 溶液和草酸(H2C2O4)溶液反应,研究外界条件对反应速率的影响,实验操作及现象如下:
编号 | 实验操作 | 实验现象 |
I | 向一支试管中先加入 1 mL 0.01 mol/L 酸 性 KMnO4 溶液,再加入 1 滴 3 mol/L 硫酸和 9 滴蒸馏水,最后加入 1 mL 0.1 mol/L草酸溶液 | 前 10 min 内溶液紫色无明显变化,后颜色逐渐变浅, 30 min 后几乎变为无色 |
II | 向另一支试管中先加入 1 mL 0.01 mol/L 酸性 KMnO4 溶液,再加入 10 滴 3 mol/L硫酸,最后加入 1 mL 0.1 mol/L 草酸溶液 | 80 s 内溶液紫色无明显变 化,后颜色迅速变浅,约 150 s 后几乎变为无色 |
(1)补全高锰酸钾与草酸反应的离子方程式:5H2C2O4 + 2MnO4- + 6H+ =2Mn2+ +_____+_____
(2)由实验 I、II 可得出的结论是_____。
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图2所示。
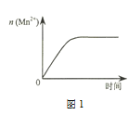
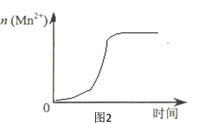
该小组同学根据图2所示信息关于实验II中80 s后溶液颜色迅速变浅的原因,该小组提出了猜想提出了新的猜想,并继续进行实验探究。
Ⅰ.该小组同学提出的猜想是_____。
Ⅱ.请你帮助该小组同学完成实验方案,并填写表中空白。
(实验内容及记录)(H2C2O4 溶液足量)
实验编号 | 室温下,试管中所加试剂及其用量 / mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间 / min | ||
0.1 mol/L H2C2O4 溶液 | 0.01 mol/L KMnO4 溶液 | 3 mol/L 稀硫酸 | |||
1 | 1.0 | 1.0 | 10 滴 | 无 | 150S |
2 | 1.0 | 1.0 | 10 滴 | _____ | t |
Ⅲ.若该小组同学提出的猜想成立,则 t______“>”“<”“=”) 150S应观察到的现象是_____。
(4)该小组拟采用如图所示的实验方案继续探究外界条件对反应速率的影响。
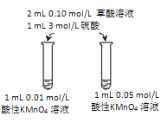
① 他们拟研究的影响因素是_____。
② 你认为他们的实验方案_____(填“合理”或“不合理”),理由是_________。