题目内容
下列说法正确的是
| A.强电解质溶液的导电能力一定比弱电解质溶液的强 |
B.一定温度下,可逆反应2X (g)+Y (g)  2Z (g)达到平衡的标志是:容器内X、Y、Z的物质的量之比为2:1:2 2Z (g)达到平衡的标志是:容器内X、Y、Z的物质的量之比为2:1:2 |
| C.升高温度,AgCl的溶解度增大,Ksp增大 |
| D.FeCl3、KAl(SO4)2、Na2CO3的水溶液均显酸性 |
C
解析试题解析:A、溶液的导电能力与离子浓度、离子所带电荷的多少有关,与电解质的强弱无关,错误;B、一定条件下的可逆反应到达化学平衡时是指各物质的浓度保持恒定的状态,错误;C、溶解反应是吸热反应,当温度升高时,溶解平衡正向移动,离子浓度增大,平衡常数增大,正确;D、Na2CO3的水溶液显碱性,错误,答案选C。
考点:考查溶液的导电能力、平衡标志的判断、平衡常数的变化、及盐溶液的酸碱性

练习册系列答案
相关题目
下列叙述正确的是( )
| A.常温下,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同 |
| B.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的ΔH<0 |
| C.常温下,将pH =10的氨水稀释,溶液中所有离子浓度都减小 |
| D.常温下,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 |
决定化学反应速率的根本因素是
| A.温度和压强 | B.反应物的浓度 | C.反应物的性质 | D.催化剂 |
在密闭容器中的一定量混合气体发生反应:  平衡时测得A的浓度为0. 5mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时A的浓度变为0. 3m ol/L。下列有关判断正确的是
平衡时测得A的浓度为0. 5mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时A的浓度变为0. 3m ol/L。下列有关判断正确的是
| A.B的转化率降低 |
| B.x+y<z |
| C.平衡向正反应方向移动 |
| D.C的体积分数增大 |
难挥发性二硫化钽(TaS2 )可采用如下装置提纯。将不纯的TaS2 粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中。反应如下: TaS2(g)+ 2I2(g)TaI4(g) + S2(g),下列说法错误的是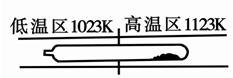
| A.在不同温度区域,TaI4 的量不同 |
| B.在提纯过程中,S2 的量不断增多 |
| C.该反应的平衡常数不随TaI4 和S2 的浓度增大而增大 |
| D.在提纯过程中,I2 的作用是将TaS2 从高温区转移到低温区 |
下列叙述中,不能用平衡移动原理解释的是( )
| A.红棕色的NO2,加压后颜色先变深后变浅 |
| B.高压比常压有利于合成SO3的反应 |
| C.由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 |
| D.黄绿色的氯水光照后颜色变浅 |
在1 100℃,一定容积的密闭容器中发生反应:FeO(s)+CO(g) Fe(s)+CO2(g)ΔH="a" kJ/mol(a>0),该温度下K=0.263,下列有关该反应的说法正确的是( )
Fe(s)+CO2(g)ΔH="a" kJ/mol(a>0),该温度下K=0.263,下列有关该反应的说法正确的是( )
| A.若生成1 mol Fe,则吸收的热量小于a kJ |
| B.若要提高CO的转化率,则应该加入适当的过量FeO |
| C.若容器内压强不随时间变化,则可以判断该反应已达到化学平衡状态 |
| D.达到化学平衡状态时,若c(CO)="0.100" mol/L,则c(CO2)="0.026" 3 mol/L |
 zC(g),图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )。
zC(g),图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )。
 2NH3(g)。图1表示在一定的温度下此反应过程中的能量的变化,图2表示在2 L的密闭容器中反应时N2的物质的量随时间的变化曲线,图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在一定的温度下此反应过程中的能量的变化,图2表示在2 L的密闭容器中反应时N2的物质的量随时间的变化曲线,图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。