题目内容
下列叙述正确的是( )
| A.常温下,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同 |
| B.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的ΔH<0 |
| C.常温下,将pH =10的氨水稀释,溶液中所有离子浓度都减小 |
| D.常温下,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 |
D
解析试题分析:A、pH=5的CH3COOH溶液对水的电离有抑制作用, pH=5的NH4Cl溶液对水的电离起促进作用;B、该反应的ΔS>0,ΔG=ΔH –TΔS。若ΔH<0,则ΔG也一定小于零,该反应能自发;C、稀释时氢氧根浓度减小,而氢离子浓度增大;D、加入少量的NH4Cl固体,消耗了氢氧根离子,平衡右移,c(Mg2+)增大,正确。
考点:考查溶液中的离子平衡、反应进行的方向。

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案下列说法正确的是
| A.强电解质溶液的导电能力一定比弱电解质溶液的强 |
B.一定温度下,可逆反应2X (g)+Y (g)  2Z (g)达到平衡的标志是:容器内X、Y、Z的物质的量之比为2:1:2 2Z (g)达到平衡的标志是:容器内X、Y、Z的物质的量之比为2:1:2 |
| C.升高温度,AgCl的溶解度增大,Ksp增大 |
| D.FeCl3、KAl(SO4)2、Na2CO3的水溶液均显酸性 |
已知反应①:CO(g)+CuO(s)??CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)  Cu(s)+H2O(g)在相同温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)
Cu(s)+H2O(g)在相同温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)  CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
A.反应①的平衡常数K1= |
| B.反应③的平衡常数K=K1/K2 |
| C.对于反应③,恒容时,若温度升高,H2的浓度减小,则该反应的焓变为正值 |
| D.对于反应③,恒温恒容时,若增大压强,H2的浓度一定减小 |
一定条件下反应N2(g)+3H2(g) 2NH3(g)在10 L的密闭容器中进行,测得
2NH3(g)在10 L的密闭容器中进行,测得
2 min内,N2的物质的量由20 mol减小到8 mol,则2 min内N2的反应速率为( )
| A.1.2 mol·L-1·min-1 | B.1 mol·L-1·min-1 |
| C.0.6 mol·L-1·min-1 | D.0.4 mol·L-1·min-1 |
用纯净的CaCO3与100 mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积),下列分析正确的是( )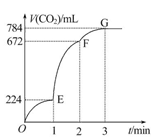
| A.OE段表示的平均速率最快 |
| B.EF段,用盐酸表示该反应的平均反应速率为0.04 mol·L-1·min-1 |
| C.OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2∶6∶7 |
| D.F点收集到的CO2的量最多 |
为了变废为宝,控制温室效应,工业上可用CO2来生产甲醇。一定条件下发生如下反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g)。如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,下列措施中不能使c(CH3OH)增大的是 ( )。
CH3OH(g)+H2O(g)。如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,下列措施中不能使c(CH3OH)增大的是 ( )。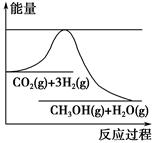
| A.降低温度 |
| B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离出来 |
| D.再充入1 mol CO2和3 mol H2 |
氨的催化氧化过程主要有以下两个反应:
(ⅰ)4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH=-905.5 kJ·mol-1
4NO(g)+6H2O(g) ΔH=-905.5 kJ·mol-1
(ⅱ)4NH3(g)+3O2(g) 2N2(g)+6H2O(g) ΔH=-1267 kJ·mol-1
2N2(g)+6H2O(g) ΔH=-1267 kJ·mol-1
测得温度对NO、N2产率的影响如图所示。下列说法错误的是( )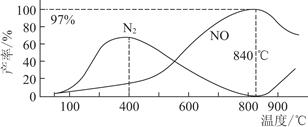
| A.升高温度,反应(ⅰ)和(ⅱ)的平衡常数均减小 |
| B.840 ℃后升高温度,反应(ⅰ)的正反应速率减小,反应(ⅱ)的正反应速率增大 |
| C.900 ℃后,NO产率下降的主要原因是反应(ⅰ)平衡逆向移动 |
| D.800 ℃左右时,氨的催化氧化主要按照(ⅰ)进行 |
下列实验事实不能用平衡移动原理解释的是( )。
A. |
B. |
C. |
D.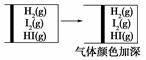 |
在一密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g) Ni(CO)4(g),已知该反应在25 ℃和80 ℃时的平衡常数分别为5×104、2,下列说法正确的是( )。
Ni(CO)4(g),已知该反应在25 ℃和80 ℃时的平衡常数分别为5×104、2,下列说法正确的是( )。
| A.上述生成Ni(CO)4(g)的反应为吸热反应 |
| B.在80 ℃时,测得某时刻Ni(CO)4、CO浓度均为0.5 mol·L-1,则此时v(正)<v(逆) |
| C.恒温恒压下,向容器中再充入少量的Ar,上述平衡将正向移动 |
| D.恒温恒容下,向容器中再充入少量Ni(CO)4(g),达新平衡时,Ni(CO)4的百分含量将增大 |