��Ŀ����
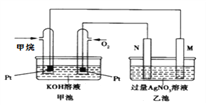
����Ŀ��ij��ѧ��ȤС��������ͼ1ʵ��װ�ý�����ȡ����غ���֤Ԫ�صķǽ��������ǿ�������飮 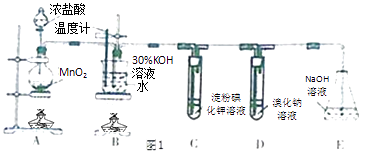
��1��Aװ���з�Ӧ�����ӷ���ʽΪ��Bװ�ò���ˮԡ���ȵ��ŵ��� ��
��2����ȡʵ�������ȡ��B���Թ���ȴ�ᾧ�����ˡ�ϴ�ӣ���ʵ�����������Ҫ�IJ��������� ��
��3�����Ե�B��Cװ�õ�λ�ã�����ܡ����ܡ������B������صIJ��ʣ�
��4����֤�ǽ�����Cl��I��ʵ�������� �� ��װ������ܡ����ܡ�����֤�ǽ�����Cl��Br��I��
��5��������ͼ2װ����֤�ǽ����ԣ�C��Si��B�м�Na2CO3 �� C�м�Na2SiO3��Һ��A��Ӧ�ü��� �� C�з�Ӧ�Ļ�ѧ����ʽ �� 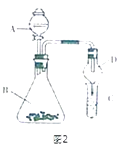
���𰸡�
��1��MnO2+4H++2Cl�� ![]() Mn2++Cl2��+2H2O���¶��أ����Ⱦ���
Mn2++Cl2��+2H2O���¶��أ����Ⱦ���
��2���ձ���©��������������ͷ�ι�
��3����
��4��C����Һ����ɫ������
��5��ϡH2SO4��CO2+Na2SiO3+H2O=H2SiO3��+Na2CO3
���������⣺Aװ�ã���Ũ����Ͷ������̼�����ȡ������Bװ�ã�ʢ������������Һ���������ȼӦ����������أ�Cװ�ã�ʢ�ŵ��۵⻯����Һ��������KI��Һ�ķ�Ӧ�����ɵⵥ�ʣ��ⵥ�������������ʾ��ɫ��Dװ�ã�Cl2+2Br��=Br2+2Cl�� �� �����ж�������ֱ���ŷŵ������У���ʢ��NaOH��Һ��Eװ������β������1��ʵ������Ũ����Ͷ������̼�����ȡ��������Ӧ����ʽΪMnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O��A�з�Ӧ�����ӷ���ʽΪ��MnO2+4H++2Cl��
MnCl2+Cl2��+2H2O��A�з�Ӧ�����ӷ���ʽΪ��MnO2+4H++2Cl�� ![]() Mn2++Cl2��+2H2O����Ӧ���¶Ȳ�����100�ȵķ�Ӧ������ֱ�Ӽ����¶ȹ��ߣ���Ӧ�¶����Կ��ƣ�ˮԡ���ȣ���Ӧ���¶Ⱥܺÿ��ƣ����Ⱦ��ȣ����Դ��ǣ�MnO2+4H++2Cl��
Mn2++Cl2��+2H2O����Ӧ���¶Ȳ�����100�ȵķ�Ӧ������ֱ�Ӽ����¶ȹ��ߣ���Ӧ�¶����Կ��ƣ�ˮԡ���ȣ���Ӧ���¶Ⱥܺÿ��ƣ����Ⱦ��ȣ����Դ��ǣ�MnO2+4H++2Cl�� ![]() Mn2++Cl2��+2H2O���¶��أ����Ⱦ��ȣ���2����ȡʵ�������ȡ��B���Թܣ�������ȴ�ᾧ������Ҫ�ձ���������Ҫ©���Ͳ�������ϴ����Ҫ���������ձ�ʢ��Һ�壬���ò��������������ý�ͷ�ι���ȡ����Һ�壬���Դ��ǣ��ձ���©��������������ͷ�ιܣ���3��ʵ�����ö������̺�Ũ��������ȡ�������Ƶõ������к����Ȼ��⣬HCl��������ˮ���ܺ�KOH��Ӧ����KCl���ʣ����Ե�B��Cװ�ã����Գ�ȥ�Ȼ������ʣ������B������صIJ��ʣ����Դ��ǣ��ܣ���4��������ԭ��Ӧ�У��������������Դ�����������������ԣ�װ��C�У������ѵ������û��ɵ��ʵ⣬Cl2+I��=I2+2Cl�� �� �������۱�������֤�ǽ�����Cl��I�����װ����û���嵥������ε��û���Ӧ��������֤��Br��I�����Դ��ǣ�C����Һ����ɫ�����ܣ���5������ǿ��������ԭ������ƿ�м�CaCO3 �� A��Һ���̼��Ʒ�Ӧ��ȡ������̼����ѡ��ϡ���ᣬ�Թ���ʢװ��������Һ������̼�����Աȹ���ǿ����C��ͨ�������̼�������ɹ����������Ӧ�ķ���ʽΪCO2+Na2SiO3+H2O=H2SiO3��+Na2CO3 �� ���Դ��ǣ�ϡH2SO4��CO2+Na2SiO3+H2O=H2SiO3��+Na2CO3 ��
Mn2++Cl2��+2H2O���¶��أ����Ⱦ��ȣ���2����ȡʵ�������ȡ��B���Թܣ�������ȴ�ᾧ������Ҫ�ձ���������Ҫ©���Ͳ�������ϴ����Ҫ���������ձ�ʢ��Һ�壬���ò��������������ý�ͷ�ι���ȡ����Һ�壬���Դ��ǣ��ձ���©��������������ͷ�ιܣ���3��ʵ�����ö������̺�Ũ��������ȡ�������Ƶõ������к����Ȼ��⣬HCl��������ˮ���ܺ�KOH��Ӧ����KCl���ʣ����Ե�B��Cװ�ã����Գ�ȥ�Ȼ������ʣ������B������صIJ��ʣ����Դ��ǣ��ܣ���4��������ԭ��Ӧ�У��������������Դ�����������������ԣ�װ��C�У������ѵ������û��ɵ��ʵ⣬Cl2+I��=I2+2Cl�� �� �������۱�������֤�ǽ�����Cl��I�����װ����û���嵥������ε��û���Ӧ��������֤��Br��I�����Դ��ǣ�C����Һ����ɫ�����ܣ���5������ǿ��������ԭ������ƿ�м�CaCO3 �� A��Һ���̼��Ʒ�Ӧ��ȡ������̼����ѡ��ϡ���ᣬ�Թ���ʢװ��������Һ������̼�����Աȹ���ǿ����C��ͨ�������̼�������ɹ����������Ӧ�ķ���ʽΪCO2+Na2SiO3+H2O=H2SiO3��+Na2CO3 �� ���Դ��ǣ�ϡH2SO4��CO2+Na2SiO3+H2O=H2SiO3��+Na2CO3 ��

 ��ս100��Ԫ����Ծ�ϵ�д�
��ս100��Ԫ����Ծ�ϵ�д�