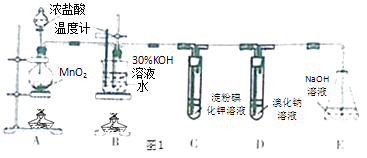
题目内容
【题目】X、Z、Q、R、T、U分别代表原子序数依次增大的短周期元素,周期表的全部元素中X的原子半径最小,X与R的最外层电子数相等;Z的内层电子数是最外层电子数的一半,U的最高化合价和最低化合物的代数和为6;R和Q可形原子数之比为1:1和2:1的两种化合物;R、T、U三者的最高价氧化物对应的水化物两两之间能发生化学反应. 请回答下列问题:
(1)T元素在期表中的位置是;由上述元素中的四种元素形成的既含有离子键又含有共价键的化合物为(写出其中一种物质的名称).
(2)X、Z、Q三种元素的原子半径由小到大顺序为(填元素符号).
(3)T、U两元素最高价氧化物对应的水化物反应的离子方程式为 .
(4)下列可以判断R和T金属性强弱的是(填序号). a.单质的熔点R比T低
b.单质与酸反应时,失电子数R比T少
c.单质与水反应R比T剧烈
d.最高价氧化物的水化物的碱性R比T强
(5)某同学用Q、R两元素的单质反应生成固体物质R2Q2 , R2Q2属于离子化合物,且能与化合物X2Q反应生成Q的单质.R2Q2的电子式为;R2Q2与X2Q反应的化学方程式为 .
【答案】
(1)第三周期ⅢA族;碳酸氢钠、醋酸钠、四羟基合铝酸钠等
(2)H<O<C
(3)Al(OH)3+3H+=Al3++3H2O
(4)cd
(5)![]() ;2Na2O2+2H2O=4NaOH+O2↑
;2Na2O2+2H2O=4NaOH+O2↑
【解析】解:X、Z、Q、R、T、U分别代表原子序数依次增大的短周期元素,周期表的全部元素中X的原子半径最小,则X为H元素.X与R的最外层电子数相等,二者原子序数相差大于2,故R为Na,可知Z、Q处于第二周期,Z的内层电子数是最外层电子数的一半,Z的原子最外层电子数为4,故Z为碳元素;U的最高化合价和最低化合物的代数和为6,则U为Cl,R和Q可形原子数之比为1:1和2:1的两种化合物,则Q为O元素,R、T、U三者的最高价氧化物对应的水化物两两之间能发生化学反应,可推知T为Al.(1)T为Al,元素在期表中的位置是第三周期ⅢA族,由上述元素中的四种元素形成的既含有离子键又含有共价键的化学物为碳酸氢钠、醋酸钠、四羟基合铝酸钠等,所以答案是:第三周期ⅢA族;碳酸氢钠、醋酸钠、四羟基合铝酸钠等;(2)同周期自左而右原子半径减小,所有元素中H原子半径最小,故原子半径:H<O<C,所以答案是:H<O<C;(3)T、U两元素最高价氧化物对应的水化物分别为Al(OH)3、HClO4 , 反应的化学方程式为:Al(OH)3+3HClO4=Al(ClO4)3+3H2O,强酸,可溶性盐拆,故离子方程式为Al(OH)3+3H+=Al3++3H2O,所以答案是:Al(OH)3+3H+=Al3++3H2O;(4)a.单质的熔点属于物理性质,不能判断金属性强弱,故a错误;b.金属性强弱与失去电子数目多少无关,与失去电子难易程度有关,故b错误;c.金属性越强,单质与水反应越剧烈,故c正确;d.金属性越强,最高价氧化物的水化物的碱性越强,故d正确;cd;(5)R2Q2为Na2O2 , 电子式为 ![]() ,Na2O2与H2O反应生成氢氧化钠与氧气,故化学方程式为2Na2O2+2H2O=4NaOH+O2↑,所以答案是:
,Na2O2与H2O反应生成氢氧化钠与氧气,故化学方程式为2Na2O2+2H2O=4NaOH+O2↑,所以答案是: ![]() ;2Na2O2+2H2O=4NaOH+O2↑.
;2Na2O2+2H2O=4NaOH+O2↑.

 阅读快车系列答案
阅读快车系列答案【题目】工业上消除氮氧化物的污染,可用如下反应:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g)ΔH在温度T1和T2时,分别将0.50 mol CH4和1.2 mol NO2充入体积为1 L的密闭容器中,测得n(CH4)随时间变化数据如下表:
N2(g)+CO2(g)+2H2O(g)ΔH在温度T1和T2时,分别将0.50 mol CH4和1.2 mol NO2充入体积为1 L的密闭容器中,测得n(CH4)随时间变化数据如下表:
温度 | 时间/min | 0 | 10 | 20 | 40 | 50 |
T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | …… | 0.15 |
下列说法正确的是()
A. 0~10 min内,T1时V(CH4)的平均反应速率比T2时的平均反应速率小
B. T2时,CH4的平衡转化率为35%
C. T1时,40min后,断裂4molC-H键同时生成4molO-H
D. 该反应的ΔH >0,T1<T2
【题目】下列实验中,所采取的分离方法与对应原理都正确的是( )
选项 | 目的 | 分离方法 | 原理 |
A. | 分离溶于水中的碘 | 乙醇萃取 | 碘在乙醇中的溶解度较大 |
B. | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯和乙醇的密度不同 |
C. | 除去KNO3固体中混杂的NaCl | 重结晶 | NaCl在水中的溶解度很大 |
D. | 除去丁醇中的乙醚 | 蒸馏 | 丁醇与乙醚的沸点相差较大 |
【题目】下列有机化学反应方程式及反应类型均正确的是( )
选项 | 化学反应方程式 | 反应类型 |
A | CH3COOH+CH3CH2OH | 取代反应 |
B | CH4+Cl2 | 置换反应 |
C | CH3CH=CH2+Br2 CH2BrCH2CH2Br | 加成反应 |
D |
| 取代反应 |
A. A B. B C. C D. D