题目内容
【题目】某甲烷燃料电池工作时的装置如图所示,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少。请回答下列问题:
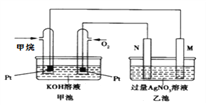
(1)铁电极为乙池中___电极(填“M”或“N”);N极的电极反应式为____________;通入甲烷的铂电极的电极反应式为____。
(2)在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗氧气_______L(标准状况下);若此时乙池溶液的体积为400mL,则乙池中溶液的c(H+)为___mol·L-1。
【答案】 M 4OH--4e-===2H2O+O2↑ CH4-8e-+10OH-=CO32—+7H2O 0.224 0.1
【解析】试题分析:本题考查甲烷燃料电池电极反应式的书写,电解池电极材料的判断和电化学的有关计算。
(1)甲池的甲烷燃料电池中通入甲烷的Pt电极为负极,通入O2的Pt电极为正极;乙池中M与甲池中的负极相连,M为阴极,N为阳极;工作时M、N两个电极的质量都不减少,铁为活性电极,若铁为阳极,铁的质量应减少,铁只能为阴极,铁电极为乙池中的M;N为石墨电极,为阳极,电极反应式为4OH--4e-=O2↑+2H2O 。甲烷燃料电池中的电解质溶液为KOH溶液,在碱性条件下CH4被氧化成CO32-,通入甲烷的Pt电极的电极反应式为CH4-8e-+10OH-=CO32—+7H2O。
(2)n(Ag)=![]() =0.04mol,乙池中析出金属Ag的是阴极,电极反应式为Ag++e-=Ag,则电路中通过的电子物质的量为0.04mol,根据电子守恒,甲池中消耗氧气物质的量为0.04mol
=0.04mol,乙池中析出金属Ag的是阴极,电极反应式为Ag++e-=Ag,则电路中通过的电子物质的量为0.04mol,根据电子守恒,甲池中消耗氧气物质的量为0.04mol![]() 4=0.01mol,消耗氧气在标准状况下的体积为0.01mol
4=0.01mol,消耗氧气在标准状况下的体积为0.01mol![]() 22.4L/mol=0.224L。乙池中反应的离子方程式为4Ag++2H2O
22.4L/mol=0.224L。乙池中反应的离子方程式为4Ag++2H2O![]() 4Ag+4H++O2↑,则生成的H+物质的量为0.04mol,c(H+)=0.04mol
4Ag+4H++O2↑,则生成的H+物质的量为0.04mol,c(H+)=0.04mol![]() 0.4L=0.1mol/L。
0.4L=0.1mol/L。

 应用题作业本系列答案
应用题作业本系列答案【题目】下列有机化学反应方程式及反应类型均正确的是( )
选项 | 化学反应方程式 | 反应类型 |
A | CH3COOH+CH3CH2OH | 取代反应 |
B | CH4+Cl2 | 置换反应 |
C | CH3CH=CH2+Br2 CH2BrCH2CH2Br | 加成反应 |
D |
| 取代反应 |
A. A B. B C. C D. D
【题目】具有下列性质的有机化合物中同分异构体数目最多的是(不考虑立体异构)( )
选项 | A | B | C | D |
分子式 | C4H8Cl2 | C5H10O2 | C4H8O2 | C9H12 |
类别 | 含氯化合物 | 羧酸 | 酯 | 含有苯环的烃 |
A. A B. B C. C D. D