题目内容
【题目】工业上利用废铝屑(含Al、Al2O3、Fe及Fe的氧化物)制取纯净的无水氯化铝,主要过程如下:
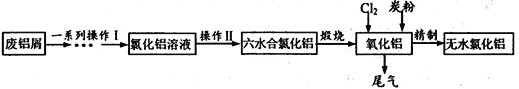
(1)检验氯化铝溶液中是否含有微量的Fe3+,可用的试剂为__________。
(2)操作II的步骤为__________、结晶、过滤、洗涤。
(3)煅烧过程的化学反应方程式为____________________。
(4)在强热条件下,Al2O3转化为AlCl3的反应如下:
Al2O3(s)+3Cl2(g)+3C(s)=2AlCl3(g)+3CO(g) △H>0
Al2O3(s)+3Cl2(g)+ ![]() C(s)=2AlCl3(g)+
C(s)=2AlCl3(g)+ ![]() CO2 (g) △H<0
CO2 (g) △H<0
工业上在通氯气的同时鼓入适量的氧气,其目的是:
①除去多余的碳粉;②_________。
(5)利用下列试剂设计由废铝制备氧化铝溶液的“一系列操作I”的实验方案:________。
实验中可供选择的试剂:6mol·L-1HCl溶液、3 mol·L-1H2SO4溶液、6mol·L-1NaOH溶液、氨水、H2O、CO2。
(6)AlCl3的熔点为190℃,沸点为183℃。1973年美国Alcoa公司研究出一种新的氯化铝电解制铝法。将AlCl3和NaCl、KCl、LiCl混溶电解冶炼铝,其中NaCl、KCl、LiC的作用是________。
【答案】 KSCN溶液(或苯酚溶液) 蒸发浓缩 2[AlCl3·6H2O]![]() Al2O3+6HCl↑+9H2O↑ 减少尾气中的CO含量或利用C、CO与O2反应放出热量维持反应所需的温度。 将废铝屑溶于适量的6mol·L-1NaOH溶液,充分搅拌,过滤,向滤液中通入足量的CO2,充分反应后过滤,洗涤固体。将所得固体溶于适量的6mol·L-1盐酸[或:将废铝屑溶于适量的6mol·L-1盐酸(或3mol·L-1H2SO4)溶液,充分搅拌,向所得溶液中加入足量的6mol·L-1 NaOH溶液,充分搅拌后过滤,向滤液中通入足量的CO2,充分反应后过滤,洗涤固体将所得固体溶于适量的6mol·L-1盐酸]。 增强熔融的导电性。
Al2O3+6HCl↑+9H2O↑ 减少尾气中的CO含量或利用C、CO与O2反应放出热量维持反应所需的温度。 将废铝屑溶于适量的6mol·L-1NaOH溶液,充分搅拌,过滤,向滤液中通入足量的CO2,充分反应后过滤,洗涤固体。将所得固体溶于适量的6mol·L-1盐酸[或:将废铝屑溶于适量的6mol·L-1盐酸(或3mol·L-1H2SO4)溶液,充分搅拌,向所得溶液中加入足量的6mol·L-1 NaOH溶液,充分搅拌后过滤,向滤液中通入足量的CO2,充分反应后过滤,洗涤固体将所得固体溶于适量的6mol·L-1盐酸]。 增强熔融的导电性。
【解析】考查化学工艺流程,涉及化学反应原理、离子检验等知识,(1)检验Fe3+一般用KSCN溶液,如果溶液显红色,说明溶液含有Fe3+;(2)因为是从溶液中得到带有结晶水的物质,因此操作II是蒸发浓缩、结晶、过滤、洗涤;(3)煅烧过程中得到氧化铝,因此反应方程式为:2[AlCl3·6H2O] ![]() Al2O3+6HCl↑+9H2O;(4)根据反应,产物中有CO,CO有毒,污染空气,因此通入适量的氧气可以减少尾气中的CO含量,第二个反应是吸热反应,C、CO与氧气反应是放热反应,维持反应所需的温度;(5)Al和Al2O3可以与NaOH反应,生成NaAlO2,而铁和铁的氧化物不与NaOH反应,因此有:将废铝屑溶于适量的6mol·L-1NaOH溶液,充分搅拌,过滤,向滤液中通入足量的CO2,充分反应后过滤,洗涤固体。将所得固体溶于适量的6mol·L-1盐酸;也可以先加入盐酸,利用氢氧化铝表现两性,向与盐酸反应后的溶液中加入足量的NaOH溶液,过滤,向滤液中通入足量的CO2,得到氢氧化铝沉淀,加盐酸溶解,具体操作是:将废铝屑溶于适量的6mol·L-1盐酸(或3mol·L-1H2SO4)溶液,充分搅拌,向所得溶液中加入足量的6mol·L-1 NaOH溶液,充分搅拌后过滤,向滤液中通入足量的CO2,充分反应后过滤,洗涤固体将所得固体溶于适量的6mol·L-1盐酸;(6)因为AlCl3属于分子晶体,熔融状态下不导电,因此为了增强导电能力,需要加入NaCl、KCl、LiCl。
Al2O3+6HCl↑+9H2O;(4)根据反应,产物中有CO,CO有毒,污染空气,因此通入适量的氧气可以减少尾气中的CO含量,第二个反应是吸热反应,C、CO与氧气反应是放热反应,维持反应所需的温度;(5)Al和Al2O3可以与NaOH反应,生成NaAlO2,而铁和铁的氧化物不与NaOH反应,因此有:将废铝屑溶于适量的6mol·L-1NaOH溶液,充分搅拌,过滤,向滤液中通入足量的CO2,充分反应后过滤,洗涤固体。将所得固体溶于适量的6mol·L-1盐酸;也可以先加入盐酸,利用氢氧化铝表现两性,向与盐酸反应后的溶液中加入足量的NaOH溶液,过滤,向滤液中通入足量的CO2,得到氢氧化铝沉淀,加盐酸溶解,具体操作是:将废铝屑溶于适量的6mol·L-1盐酸(或3mol·L-1H2SO4)溶液,充分搅拌,向所得溶液中加入足量的6mol·L-1 NaOH溶液,充分搅拌后过滤,向滤液中通入足量的CO2,充分反应后过滤,洗涤固体将所得固体溶于适量的6mol·L-1盐酸;(6)因为AlCl3属于分子晶体,熔融状态下不导电,因此为了增强导电能力,需要加入NaCl、KCl、LiCl。

【题目】25 ℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液。观察到的现象是先出现黄色沉淀,最终出现黑色沉淀。已知有关物质的溶度积Ksp(25 ℃)如下:
AgCl | AgI | Ag2S | |
Ksp(单位省略) | 1.8×10-10 | 1.5×10-16 | 6.3×10-50 |
下列叙述错误的是 ( )
A.沉淀转化的实质就是沉淀溶解平衡的移动
B.溶解度小的沉淀可以转化为溶解度更小的沉淀
C.AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解程度相同
D.25 ℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度不同
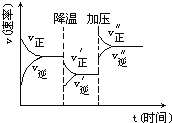
【题目】工业制硫酸的反应原理主要有下列三个反应:
①FeS2(s)+O2(g)![]() Fe2O3(s)+SO2(g);ΔH1
Fe2O3(s)+SO2(g);ΔH1
②2SO2(g)+O2(g)![]() 2SO3(g); ΔH2
2SO3(g); ΔH2
③SO3+H2O=H2SO4
Ⅰ.(1)反应①配平后各物质系数分别为_____、______、_______、______。若每生成1molSO2时反应放热426.5kJ,则ΔH1=_______________。
(2)工业生产中将FeS2矿石粉碎后投入反应器中反应,这样做的目的是___________。
Ⅱ.下表是不同温度和压强下反应②中SO2的转化率
0.1Mp | 0.5Mp | 1Mp | 10Mp | |
400℃ | 99.2 | 99.6 | 99.7 | 99.9 |
500℃ | 93.5 | 96.9 | 97.8 | 99.3 |
600℃ | 73.7 | 85.8 | 89.5 | 96.4 |
(3)反应②是气体体积缩小的可逆反应,增大压强有利于提高原料转化率,但工业生产中该反应在常压下进行,采用常压生产条件的理由是_______________________。
(4)若原料气组成:SO2 7%,O211%,N2 82%,在温度和压强不变的条件下,混合气体体积变为原来的97.2%,则SO2的转化率为_________。
Ⅲ.尾气中的二氧化硫对环境造成污染,需要处理后才能排放。常用亚硫酸钠吸收法。
(5)Na2SO3溶液吸收SO2的离子方程式为________________________ ;
(6)常温下,当吸收至pH=6时,吸收液中相关离子浓度关系一定正确的是____(填序号)
A.c(Na+)+c(H+)>c(SO32-)+c(HSO3-)+c(OH-)
B.c(Na+)=c(SO32-)+c(HSO3-)+C(H2SO3)
C.c(Na+)>c(SO32-)>c(OH-)>c(H+)
D.水电离出c(OH-)=l×l0-8 mol·L-1
【题目】下列实验操作和所用装置能达到实验目的的是
选项 | A | B | C | D |
实验 目的 | 检验蔗糖与浓硫酸反应产物中有CO2 | 证明Fe(NO3)2溶液中存在Fe2+的水解平衡 | 检验某溶液中含有Ag+ | 比较非金属性:S>C>Si |
实验 操作 | 将浓硫酸滴入圆底烧瓶中,再将生成的气体通入澄清石灰水 | 将稀硝酸滴入Fe(NO3)2溶液中 | 向待检液中滴加足量的稀盐酸 | 将稀硫酸滴入锥形瓶中,再将生成的气体通入Na2SiO3溶液中 |
所用 装置 |
|
|
|
|
A. A B. B C. C D. D