题目内容
8.下列关于物质分类中不正确的是( )| A. | 纯碱属于碱 | B. | 食盐属于盐 | ||
| C. | 干冰属于分子晶体 | D. | 含有离子键的物质属于离子化合物 |
分析 A、水溶液中电离出的阴离子全部是氢氧根离子的化合物;
B、由金属阳离子和酸根阴离子构成的属于盐;
C、干冰是二氧化碳晶体由分子构成;
D、以离子键结合的化合物一定是离子化合物;
解答 解:A、纯碱是碳酸钠属于盐,不是碱,故A错误;
B、食盐是氯化钠属于盐,故B正确;
C、干冰是二氧化碳固体,是由二氧化碳分子构成属于分子晶体,故C正确;
D、以离子键结合的化合物一定是离子化合物,故D正确;
故选A.
点评 本题考查了物质类别,物质构成,物质结构特征分析,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
19.与溴水、酸性高锰酸钾溶液、氢氧化铜悬浊液、碳酸氢钠都能反应的是( )
| A. | CH3CH2CHO | B. |  | C. | CH2=CH2 | D. | HOOCCH=CH2 |
3.如图是可逆反应X2+3Y2?2Z2 在反应过程中的反应速率(V)与时间(t)的关系曲线,下列叙述正确的是( )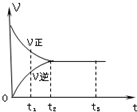

| A. | t1时,只有正反应继续进行 | B. | t2时,反应停止 | ||
| C. | t2-t3,反应不再是可逆反应 | D. | t2-t3,各物质的浓度不再发生变化 |
20.下列粒子中,与K+含有相同电子数的是( )
| A. | F- | B. | Cl- | C. | Br- | D. | I- |
17.利用原电池原理可以探究金属的活动性.
(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计.锌片做负极(填“正”或“负”),锌片上发生的电极反应式是Zn-2e-=Zn2+;银片上发生的电极反应式是2H++2e-=H2↑.
(2)若该电池中两电极的总质量为60g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47g.此时产生标准状况下氢气的体积为4.48L,通过导线的电子的物质的量为0.4mol.
(3)为证明铁的金属活动性比铜强,某同学设计了如下一些方案.其中能证明铁的金属活动性比铜强的方案是①③④.(填序号)
(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计.锌片做负极(填“正”或“负”),锌片上发生的电极反应式是Zn-2e-=Zn2+;银片上发生的电极反应式是2H++2e-=H2↑.
(2)若该电池中两电极的总质量为60g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47g.此时产生标准状况下氢气的体积为4.48L,通过导线的电子的物质的量为0.4mol.
(3)为证明铁的金属活动性比铜强,某同学设计了如下一些方案.其中能证明铁的金属活动性比铜强的方案是①③④.(填序号)
| 方 案 | 现象或产物 |
| ①将铁片置于CuSO4溶液中 | 铁片上有亮红色物质析出 |
| ②将铁丝和铜丝分别在氯气燃烧 | 产物分别为FeCl3和CuCl2 |
| ③将铁片和铜片分别置于稀硫酸溶液中 | 铁片上有气泡产生,铜片上无气泡产生 |
| ④将铁片和铜片置于盛有稀硫酸的烧杯中,并用导线连接 | 铁片溶解,铜片上有气泡产生 |
18.使用氢氧燃料电池的汽车已在北京街头出现.以30% KOH溶液为电解质溶液的这种电池在使用时的电极反应如下:2H2+4OH--4e-═4H2O O2+2H2O+4e-═4OH-
下列有关该氢氧燃料电池的说法中,正确的是( )
下列有关该氢氧燃料电池的说法中,正确的是( )
| A. | H2在正极发生氧化反应 | |
| B. | 供电时的总反应是 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O | |
| C. | 氢氧燃料电池中反应放出的热量转变为电能 | |
| D. | 电解质溶液中OH-向负极移动 |
 .
.
 .
.
 .
.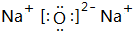 、
、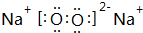 .(写两个)
.(写两个)