题目内容
实验室用密度为1.18g?mL-1,质量分数为36.5%浓盐酸配制250mL0.1mol?L-1的盐酸溶液,填空并请回答下列问题:
(1)配制250mL0.1mol?L-1的盐酸溶液
(2)用量筒准确量取所需的浓盐酸的体积,用适量水在烧杯中稀释,等______后,溶液注入容量瓶,这是为了防止所配溶液的浓度偏______(填大或小),洗涤烧杯后,将洗涤液都移入容量瓶,其目的是______;
(3)若出现如下情况,所配溶液的浓度偏高的是______(填写字母).
A、没有进行洗涤烧杯;B、加蒸馏水时不慎超过了刻度;C、若定容时俯视刻度线;D、量取浓盐酸时仰视量筒;E、将量筒洗涤并将洗涤液转移到容量瓶中;F、转移溶液前容量瓶中有少量水.
(1)配制250mL0.1mol?L-1的盐酸溶液
| 应称量盐酸体积/mL | 应选用容量 瓶的规格/mL | 除容量瓶外 还需要的其它仪器 |
(3)若出现如下情况,所配溶液的浓度偏高的是______(填写字母).
A、没有进行洗涤烧杯;B、加蒸馏水时不慎超过了刻度;C、若定容时俯视刻度线;D、量取浓盐酸时仰视量筒;E、将量筒洗涤并将洗涤液转移到容量瓶中;F、转移溶液前容量瓶中有少量水.
(1)浓盐酸的物质的量浓度=
mol/L=11.8mol/L,
配制250mL0.1mol?L-1的盐酸溶液,故需要250mL容量瓶,
令需浓盐酸的体积为V,根据稀释定律,稀释前后溶质的物质的量不变,所以V×11.8mol/L=250mL×0.1mol/L,解得:V=2.1mL,
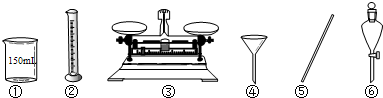
配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,一般用量筒量取(用到胶头滴管)称量,在烧杯中稀释,冷却后转移到250mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:玻璃棒、烧杯、胶头滴管、量筒、250mL容量瓶,
故答案为:2.1mL;250mL;玻璃棒、烧杯、胶头滴管、量筒;
(2)浓盐酸稀释会放出大量的热,应冷却恢复室温;不冷却即转移定容导致所配溶液的体积偏小,所配溶液浓度偏大;
烧杯壁沾有溶质,将洗涤液都移入容量瓶,保证溶质全部转移到容量瓶内,
故答案为:冷却;大;保证溶质全部转移到容量瓶内;
(3)A、烧杯未洗涤,导致溶质的物质的量偏小,配制的溶液浓度偏低,故A不符合;
B、加蒸馏水时不慎超过了刻度,溶液体积偏大,所配溶液浓度偏低,故B不符合;
C、若定容时俯视刻度线,液面在刻度线以下,溶液体积偏小,所配溶液浓度偏高,故C不符合;
D、量取浓盐酸时仰视量筒,量取浓盐酸的体积偏大,所配溶液浓度偏高,故D符合;
E、量筒为流量式仪器,不需要洗涤,将量筒洗涤并将洗涤液转移到容量瓶中,导致HCl的物质的量偏大,所配溶液浓度偏高,故E符合;
F、溶液配制需加水定容,转移溶液前容量瓶中有少量水,对所配溶液浓度无影响,故D不符合,
故选:CDE.
| 1000×1.18×36.5% |
| 36.5 |
配制250mL0.1mol?L-1的盐酸溶液,故需要250mL容量瓶,
令需浓盐酸的体积为V,根据稀释定律,稀释前后溶质的物质的量不变,所以V×11.8mol/L=250mL×0.1mol/L,解得:V=2.1mL,
配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,一般用量筒量取(用到胶头滴管)称量,在烧杯中稀释,冷却后转移到250mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:玻璃棒、烧杯、胶头滴管、量筒、250mL容量瓶,
故答案为:2.1mL;250mL;玻璃棒、烧杯、胶头滴管、量筒;
(2)浓盐酸稀释会放出大量的热,应冷却恢复室温;不冷却即转移定容导致所配溶液的体积偏小,所配溶液浓度偏大;
烧杯壁沾有溶质,将洗涤液都移入容量瓶,保证溶质全部转移到容量瓶内,
故答案为:冷却;大;保证溶质全部转移到容量瓶内;
(3)A、烧杯未洗涤,导致溶质的物质的量偏小,配制的溶液浓度偏低,故A不符合;
B、加蒸馏水时不慎超过了刻度,溶液体积偏大,所配溶液浓度偏低,故B不符合;
C、若定容时俯视刻度线,液面在刻度线以下,溶液体积偏小,所配溶液浓度偏高,故C不符合;
D、量取浓盐酸时仰视量筒,量取浓盐酸的体积偏大,所配溶液浓度偏高,故D符合;
E、量筒为流量式仪器,不需要洗涤,将量筒洗涤并将洗涤液转移到容量瓶中,导致HCl的物质的量偏大,所配溶液浓度偏高,故E符合;
F、溶液配制需加水定容,转移溶液前容量瓶中有少量水,对所配溶液浓度无影响,故D不符合,
故选:CDE.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目