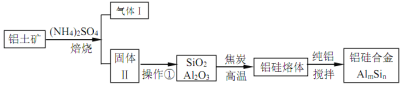
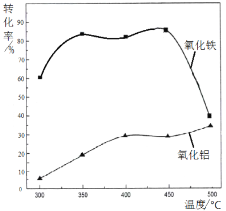
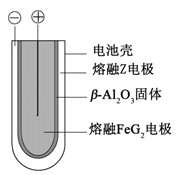
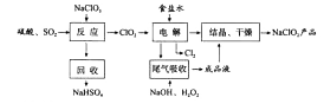
题目内容
【题目】某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):

(1) 哪一时间段(指①0~1、②1~2、③2~3、④3~4、⑤4~5 min,下同)反应速率最大 ,(填序号,下同) ,原因是 。
(2) 哪一段时段的反应速率最小 ,原因是 。
(3) 求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变,不要求写出计算过程) 。
(4) 如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:[A.蒸馏水 B.NaCl溶液 C Na2CO3溶液 D.CuSO4溶液
你认为可行的是(填编号) 。
【答案】
(1)③,该反应放热,2~3min时温度最高;
(2)⑤,溶液中H+的浓度变小;
(3)0.1mol/(L·min);
(4)AB。
【解析】
试题分析:(1)根据不同时段,产生氢气体积的变化值,得知在③反应速率最大,此反应是放热反应,在此阶段温度较高,其主导作用;(2)⑤阶段时,氢气的变化最小,反应速率最慢,是因为随反应进行c(H+)减小,在此阶段c(H+),其主导作用;(3)此阶段产生氢气的物质的量为(232-120)×10-3/22.4mol=0.005mol,消耗盐酸的物质的量为2×0.005mol=0.01mol,v(HCl)=0.01/(100×10-3×1)mol/(L·min)=0.1 mol/(L·min);(4)A、加入蒸馏水,稀释溶液,降低浓度,化学反应速率减缓,溶液中H+总物质的量不变,氢气总量不变,故正确;B、加入NaCl溶液,相当加水稀释,故正确;C、盐酸和碳酸钠反应,消耗盐酸,影响氢气的产量,故错误;D、锌置换出铜,形成原电池,加快反应速率,故错误。

 中考解读考点精练系列答案
中考解读考点精练系列答案