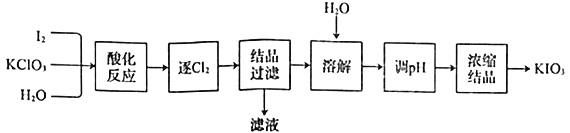
题目内容
【题目】早在1774年,瑞典化学家舍勒在研究软锰矿(主要成分![]() )的过程中,将它与浓盐酸混合加热,产生了黄绿色气体—氯气。某小组同学利用舍勒发现氯气的方法制取氯气并探究其性质。
)的过程中,将它与浓盐酸混合加热,产生了黄绿色气体—氯气。某小组同学利用舍勒发现氯气的方法制取氯气并探究其性质。

请回答:
(1)装置①中制取氯气,盛有浓盐酸的玻璃仪器名称为__________
(2)装置②的作用是________________________________________.
(3)装置③中的现象是________________________________________.
(4)装置④中反应的离子方程式是________________________________________.
【答案】分液漏斗 除去氯气中的氯化氢 有色纸条褪色 ![]()
【解析】
装置1为氯气发生装置,浓盐酸具有挥发性,生成的氯气中混有HCl气体,可用饱和食盐水除去;装置3检验湿润的氯气是否具有漂白性,装置4进行尾气处理。
(1)根据仪器结构可知该仪器为分液漏斗;
(2)浓盐酸具有挥发性,生成的氯气中混有HCl气体,可用饱和食盐水除去;
(3)湿润的氯气可生成HClO,次氯酸具有漂白性,可用观察到湿润的有色纸条褪色;
(4)氯气可以和NaOH反应生成次氯酸钠和氯化钠,离子方程式为![]() 。
。

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案
相关题目