题目内容
【题目】铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答以下问题:
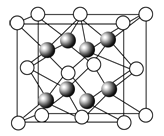
(1)元素金(Au)处于周期表中的第6周期,与Cu同族,金原子最外层电子排布式为_________;一种铜合金晶体具有立方最密堆积的结构,在晶胞中铜原子处于面心,金原子处于顶点位置,则该合金中铜原子与金原子数量之比为_____,该晶体中,原子之间的作用力是________;
(2)上述晶体具有储氢功能,氢原子可进入到由铜原子与金原子构成的四面体空隙中。若将铜原子与金原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似,该晶体储氢后的化学式应为_____________。
(3)CuSO4晶体的构成微粒是____和____,微粒间的作用力是_______,该晶体属于____晶体;
(4)SO42-中S以sp3杂化,SO42-的立体构型是__________________________;
(5)CuSO4粉末常用来检验一些有机物中的微量水分,其原因是____________。
【答案】6s1 3∶1 金属键 Cu3AuH8 Cu2+ SO42- 离子键 离子 正四面体形 白色CuSO4粉末和水结合生成蓝色的CuSO4·5H2O晶体
【解析】
(1)元素金(Au)处于周期表中的第六周期,与Cu同族,则最外层电子数为1,以此判断电子排布式,利用均摊法计算晶胞;
(2)结合(1)的分析和CaF2的结构解答;
(3)CuSO4为离子化合物;
(4)SO42-中S以sp3杂化,没有孤电子对,据此判断SO42-的立体构型;
(5)无水硫酸铜是白色的,CuSO45H2O是蓝色的,显示水合铜离子特征蓝色,据此分析解答。
(1)元素金(Au)处于周期表中的第六周期,与Cu同族,则最外层电子数为1,则最外层电子排布式为6s1。在晶胞中Cu原子处于面心,N(Cu)=6×![]() =3,Au原子处于顶点位置,N(Au)=8×
=3,Au原子处于顶点位置,N(Au)=8×![]() =1,则该合金中Cu原子与Au原子数量之比为3:1,为金属晶体,原子间的作用力为金属键;故答案为:6s1;3∶1;金属键;
=1,则该合金中Cu原子与Au原子数量之比为3:1,为金属晶体,原子间的作用力为金属键;故答案为:6s1;3∶1;金属键;
(2)上述晶体具有储氢功能,氢原子可进入到由铜原子与金原子构成的四面体空隙中。若将铜原子与金原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相同,如图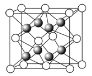 ,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,则应含有8个H,则化学式为Cu3AuH8,故答案为:Cu3AuH8;
,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,则应含有8个H,则化学式为Cu3AuH8,故答案为:Cu3AuH8;
(3)CuSO4为离子化合物,晶体的构成微粒是Cu2+和SO42-,微粒间的作用力是离子键,该晶体属于离子晶体,故答案为:Cu2+;SO42-;离子键;离子;
(4)SO42-中S以sp3杂化,没有孤电子对,SO42-的立体构型是正四面体形,故答案为:正四面体形;
(5)白色无水硫酸铜可与水结合生成蓝色的CuSO45H2O,显示水合铜离子特征蓝色,故答案为:白色无水硫酸铜可与水结合生成蓝色的CuSO45H2O晶体。

【题目】实验室以苯甲醛为原料制备间溴苯甲醛的反应如下:
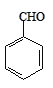 +Br2
+Br2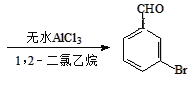 +HBr
+HBr
已知:(1)间溴苯甲醛温度过高时易被氧化。
(2)溴、苯甲醛、1,2-二氯乙烷、间溴苯甲醛的沸点见下表:
物质 | 溴 | 苯甲醛 | 1,2-二氯乙烷 | 间溴苯甲醛 |
沸点/℃ | 58.8 | 179 | 83.5 | 229 |
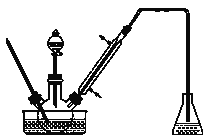
步骤1:将一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后装入三颈烧瓶(如图所示),缓慢滴加经浓硫酸干燥过的足量液溴,控温反应一段时间,冷却。
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机层用10% NaHCO3溶液洗涤。
步骤3:经洗涤的有机层加入适量无水MgSO4固体,放置一段时间后过滤出MgSO4nH2O晶体。
步骤4:减压蒸馏有机层,收集相应馏分。
(1)实验装置中冷凝管的主要作用是_______,锥形瓶中应为_______(填化学式)溶液。
(2)步骤1反应过程中,为提高原料利用率,适宜的温度范围为(填序号)_________。
A >229℃ B 58.8℃~179℃ C <58.8℃
(3)步骤2中用10% NaHCO3溶液洗涤,是为了除去溶于有机层的________(填化学式)。
(4)步骤3中加入无水MgSO4固体的作用是_______。
(5)步骤4中采用减压蒸馏,是为了防止_______。
(6)若实验中加入了5.3 g苯甲醛,得到3.7 g间溴苯甲醛。则间溴苯甲醛产率为___。
(7) ![]() 是一种重要的医药中间体。请设计合理方案用
是一种重要的医药中间体。请设计合理方案用![]() 合成这种中间体。(其他原料自选,用反应流程图表示,并注明必要的反应条件)。_______
合成这种中间体。(其他原料自选,用反应流程图表示,并注明必要的反应条件)。_______
例如:![]()
![]()
![]()
![]()
![]()