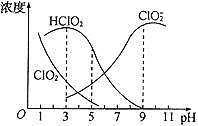
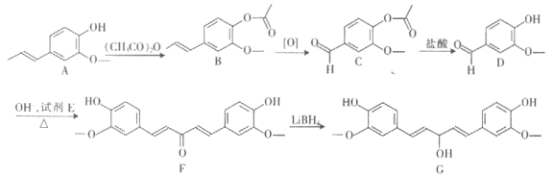
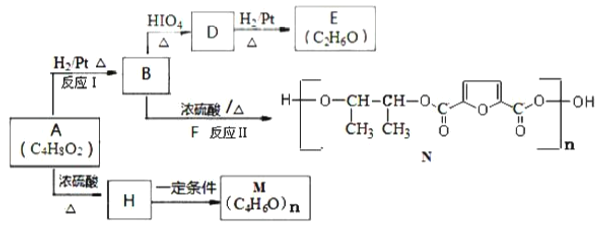
题目内容
【题目】在Na+浓度为1.0mol/L的某澄清溶液中,还可能含有K+,Mg2+,Fe3+,Ba2+,Cl-,CO32-,SO32-,SiO32-,SO42-等离子,取该溶液100ml进行下图连续实验(所加试剂均过量,气体全部逸出)。下列说法不正确的是
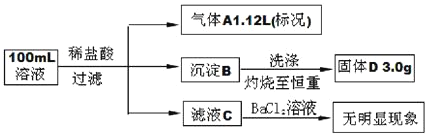
A.原溶液中一定不存在Mg2+,Fe3+,Ba2+,SO42-
B.在100ml原溶液中加入足量BaCl2溶液,至少可生成沉淀20.5g
C.为确定原溶液中是否含有Cl-,可取滤液C,加入AgNO3和稀HNO3溶液
D.原溶液一定存在K+,c(K+)可能为1.5mol/L
【答案】C
【解析】
根据溶液为澄清溶液可知:溶液中含有的离子一定能够大量共存;由加入稀盐酸产生1.12L气体可知,该溶液中一定含有CO32-,SO32-中至少一种,气体的物质的量为![]() =0.05mol,则一定没有Mg2+、Fe3+、Ba2+,CO32-、SO32-的浓度之和是0.5mol/L;由生成沉淀判断溶液中一定含有SiO32-,发生反应SiO32-+2H+=H2SiO3↓,硅酸加热分解生成二氧化硅,固体质量为3.0g为二氧化硅的质量,物质的量是
=0.05mol,则一定没有Mg2+、Fe3+、Ba2+,CO32-、SO32-的浓度之和是0.5mol/L;由生成沉淀判断溶液中一定含有SiO32-,发生反应SiO32-+2H+=H2SiO3↓,硅酸加热分解生成二氧化硅,固体质量为3.0g为二氧化硅的质量,物质的量是![]() =0.05mol。根据硅原子守恒,SiO32-的浓度为:
=0.05mol。根据硅原子守恒,SiO32-的浓度为:![]() =0.5mol/L;由加入氯化钡溶液没有明显实验现象可知溶液中不含SO42-,根据电荷守恒2×0.5mol/L+2×0.5mol/L=2mol/L>1mol/L,因此溶液中一定含有K+,且其浓度至少为1.0mol/L,不能确定Cl-是否存在。
=0.5mol/L;由加入氯化钡溶液没有明显实验现象可知溶液中不含SO42-,根据电荷守恒2×0.5mol/L+2×0.5mol/L=2mol/L>1mol/L,因此溶液中一定含有K+,且其浓度至少为1.0mol/L,不能确定Cl-是否存在。
A. 根据以上分析可知原溶液中一定不存在Mg2+、Fe3+、Ba2+、SO42-,A项正确,不符合题意;
B. 在100mL原溶液中加入足量BaCl2溶液,可生成BaSiO30.05mol质量为10.65g,BaCO3、BaSO3共0.05mol,若只有BaCO3,产生的沉淀最少,为9.85g+10.65g=20.5g,B项正确,不符合题意;
C. 滤液C中已经加入过HCl,无法确定原溶液中是否存在Cl-,C项错误,符合题意;
D. 原溶液若存在Cl-时,且为0.5mol/L时,c(K+)=1.5mol/L,D项正确,不符合题意。
答案选C。

【题目】已知反应![]() ,某研究小组将4moX和2molY置于一容积不变的密闭容器中,测定1min内X的转化率,得到的数据如表所示,下列判断正确的是( )
,某研究小组将4moX和2molY置于一容积不变的密闭容器中,测定1min内X的转化率,得到的数据如表所示,下列判断正确的是( )
t/min | 2 | 4.5 | 5 | 6 |
X的转化率 | 30% | 40% | 70% | 70% |
A.随着反应的进行,混合气体的密度不断增大
B.反应在5.5min时,![]()
C.6min时,容器中剩余1.4molY
D.其他条件不变,将X的物质的量改为10mol,则可得到4molZ