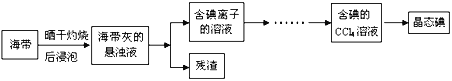
题目内容
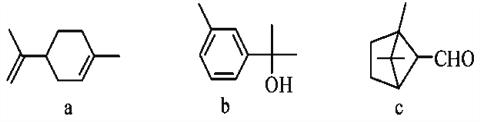
【题目】有机物的结构可用“键线式”表示,如:CH3CH==CHCH3可简写为![]() ,有机物X的键线式为
,有机物X的键线式为![]() ,下列说法不正确的是( )
,下列说法不正确的是( )
A. X与溴的加成产物可能有3种
B. X能使酸性KMnO4溶液褪色
C. X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有4种
D. Y是X的同分异构体,且属于芳香烃,则Y的结构简式为![]()
【答案】C
【解析】
A.X有三个等效的碳碳双键,Br2与其中一个双键加成得一种产物,Br2与其中两个双键加成得一种产物,Br2与三个双键加成得一种产物,A正确;
B.X含有碳碳双键,能使酸性KMnO4溶液褪色,B正确;
C.X与足量的H2反应生成环状的饱和烃![]() , 该有机物中心对称,且镜面对称,角上一种、“Y”型中心一种,共2种氢原子,一氯代物有2种,C错误;
, 该有机物中心对称,且镜面对称,角上一种、“Y”型中心一种,共2种氢原子,一氯代物有2种,C错误;
D.![]() 分子式为C8H8,不饱和度为5,则属于芳香烃的同分异构体结构简式为
分子式为C8H8,不饱和度为5,则属于芳香烃的同分异构体结构简式为![]() ,D正确;
,D正确;
答案:C。

 孟建平名校考卷系列答案
孟建平名校考卷系列答案【题目】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 | |
(1)称取A 9.0 g,升温使其汽化,测其密度是相同条件下H2的45倍 | 试通过计算填空: (1)A的相对分子质量为________。 | |
(2)将此9.0 g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4 g和13.2 g | (2)A的分子式为________。 | |
(3)另取A 9.0 g,跟足量的NaHCO3粉末反应,生成2.24 L CO2(标准状况),若与足量金属钠反应则生成2.24 L H2(标准状况) | (3)用结构简式表示A中含有的官能团:_____________。 | |
(4)A的核磁共振氢谱如图:
| (4)A中含有________种氢原子。 | |