题目内容
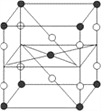
【题目】关于氢键,下列说法正确的是
A. 分子中有N、O、F原子,分子间就存在氢键
B. 因为氢键的缘故,![]() 比
比![]() 熔沸点高
熔沸点高
C. 由于氢键比范德华力强,所以H2O分子比H2S分子稳定
D. “可燃冰”——甲烷水合物(例如:8CH4·46H2O)中CH4与H2O之间存在氢键
【答案】B
【解析】
A、非金属性较强的元素N、O、F的氢化物易形成氢键,并不是分子中有N、O、F原子分子间就存在氢键,如NO分子间就不存在氢键,故A错误;
B、若形成分子内氢键的,其熔点和沸点会降低,形成分子间氢键时,物质的熔点和沸点就会升高,![]() 形成分子间氢键,
形成分子间氢键,![]() 形成分子内氢键,故
形成分子内氢键,故![]() 熔沸点高,故B正确;
熔沸点高,故B正确;
C、分子的稳定性和氢键是没有关系的,而与化学键有关系,故C错误;
D、C-H键极性非常弱,不可能与水分子形成氢键。可燃冰是因为高压下水分子通过氢键形成笼状结构,笼状结构的体积与甲烷分子相近,刚好可以容纳下甲烷分子,而甲烷分子与水分子之间没有氢键,故D错误。
正确答案选B。

 阅读快车系列答案
阅读快车系列答案【题目】下表是实验室制备气体的有关内容:
编号 | 实验内容 | 实验原理 |
① | 制氧气 | H2O2→O2 |
② | 制氨气 | NH4Cl→NH3 |
③ | 制氯气 | HCl→Cl2 |
(1)上述气体中:从制备过程看,必须选择合适的氧化剂才能实现的是_________(填气体的化学式,下同);从反应中有无电子转移的角度看,明显不同于其他气体的是______,写出实验室制取该气体的化学方程式_______________________________
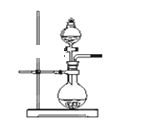
(2)若用上述装置制备NH3,则选择的试剂为____________________。
(3)制备Cl2需用8 mol/L的盐酸100mL,现用12 mol/L的盐酸来配制。
①需要12 mol/L的盐酸的体积为__________mL(精确到0.1 mL)
②在容量瓶的使用方法中,下列操作不正确的是_______________(填写标号)。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时用量筒量取浓盐酸后用玻璃棒引流入容量瓶中,缓慢加入蒸馏水到接近标线1cm~2cm处,用胶头滴管滴加蒸馏水直到凹液面的最低处和标线相平
D.定容后盖好瓶塞,用食指顶住,用另一只手手指托住瓶底,把容量瓶倒转和摇动多次