题目内容
【题目】按要求填空。
(1)某元素原子K层和M层电子数相同,该元素的元素符号是________。
(2)某元素原子L层电子数是K层电子数的3倍,该元素的元素名称是________。
(3)某元素原子最外层电子数是次外层电子数的2倍,该元素的原子结构示意图是____________。
【答案】 Mg 氧 ![]()
【解析】(1)某元素的核外K层的电子数与M层的电子数相同,则核外各电子层电子数分别为2、8、2,应为Mg元素,故答案为:Mg;
(2) K层最多排2个电子,L层电子数是K层电子数的3倍,所以L层排6个电子,所以该元素核外有8个电子,原子中原子序数=核外电子数,所以该元素的8号元素O,故答案为:氧;
(3)某元素原子的最外层电子数等于次外层电子数的2倍,最外层不超过8个电子,因此次外层为2个电子,最外层为4个电子,为C元素,其原子结构示意图为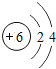 ,故答案为:
,故答案为: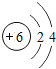 。
。

【题目】等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体积v的数据,根据数据绘制得到下图,则曲线a所对应的实验组别是( ) 
组别 | c(HCl)(molL﹣1) | 温度(℃) | 状态 |
A | 2.0 | 25 | 块状 |
B | 2.5 | 30 | 块状 |
C | 2.5 | 50 | 粉末状 |
D | 2.5 | 50 | 块状 |
A.A
B.B
C.C
D.D
【题目】为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验.Ⅰ.AgNO3的氧化性
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出.为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验.可选用试剂:①KSCN溶液 ②NaOH溶液 ③酸性KMnO4溶液 ④K3[Fe(CN)6]溶液.
(1)请完成下表:
操作 | 现象 | 结论 |
取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡 | 存在Fe3+ | |
取少量除尽Ag+后的溶液于试管中,加入1~2滴(填序号)溶液,振荡 | 存在Fe2+ |
【实验结论】Fe的氧化产物为Fe2+和Fe3+
(2)Ⅱ.AgNO3的热稳定性用如图所示的实验装置A加热固体,产生红棕色气体,在装置D中收集到无色气体.当反应结束以后,试管中残留固体为黑色.
①装置B的作用是 .
②经小组讨论并验证该无色气体为O2 , 其操作方法是 .
③【查阅资料】①Ag2O和粉末的Ag均为黑色;②Ag2O可溶于氨水.
【提出假设】试管中残留的黑色固体可能是:①Ag;②Ag2O;③Ag和Ag2O.
【实验验证】该小组为验证上述设想,分别取少量黑色固体,进行了如下实验:
实验编号 | 操 作 | 现 象 |
a | 加入足量氨水,振荡 | 黑色固体不溶解 |
b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
【实验评价】根据上述实验,不能确定固体产物成分的实验是(填实验编号).
【实验结论】根据上述实验结果,得出AgNO3固体受热分解的化学方程式为
【实验拓展】另取2.0g AgNO3样品充分受热分解,共收集到标准状况下气体的体积为336mL,则样品中AgNO3的百分含量为 .
【题目】根据下列叙述,写出元素名称并画出原子结构示意图:
信息 | 元素名称 | 原子结构示意图 |
A元素原子核外M层电子数是L层电子数的一半 | ____ | ____ |
B元素原子最外层电子数是次外层电子数的1.5倍 | ____ | ____ |
C元素+1价离子C+的电子层排布与Ne相同 | ____ | ____ |
D元素原子次外层电子数是最外层电子数的 | ____ | ____ |
