题目内容
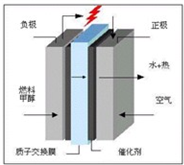
科学家预言,燃料电池将是21世纪获得电力的重要途径,美国已计划将甲醇燃料电池用于军事目的。一种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。完成下列问题:
(1)这种电极放电时发生的化学反应方程式是____________________________________。
(2)此电极的正极发生的电极反应式是__________;负极发生的电极反应式是__________。
(3)电解液中的H+向__________极移动;向外电路释放电子的电极是__________。
(4)比起直接燃烧燃料产生电力,使用燃料电池有许多优点,其中主要有两点:首先是燃料电池的能量转化效率高,其次是__________________________________________________。
解析:甲醇燃料电池实质就是利用CH3OH燃料在氧气中反应来提供电能的。CH3OH作负极,发生氧化反应,电极反应为2CH3OH+2H2O-12e-![]() 2CO2+12H+;氧气在正极反应:3O2+12H++12e-
2CO2+12H+;氧气在正极反应:3O2+12H++12e-![]() 6H2O,两反应相加即得总反应式。在电池中,正极不断消耗H+,负极不断产生H+;电子由负极流出,沿导线流向正极。由总反应式可知反应产物为CO2和H2O,对环境无污染。
6H2O,两反应相加即得总反应式。在电池中,正极不断消耗H+,负极不断产生H+;电子由负极流出,沿导线流向正极。由总反应式可知反应产物为CO2和H2O,对环境无污染。
答案:(1)2CH3OH+3O2![]() 2CO2+4H2O
2CO2+4H2O
(2)3O2+12H++12e-![]() 6H2O 2CH3OH+2H2O-12e-
6H2O 2CH3OH+2H2O-12e-![]() 2CO2+12H+
2CO2+12H+
(3)正 负极
(4)对环境无污染

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 CH3OH(g)△H1=-116kJ?molˉ1
CH3OH(g)△H1=-116kJ?molˉ1
 化的曲线图,请指明图中的压强P1=
化的曲线图,请指明图中的压强P1= CO(g)+2H2(g)反应的平衡常数为
CO(g)+2H2(g)反应的平衡常数为