题目内容
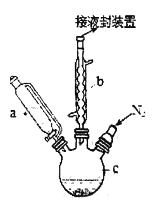
【题目】工业以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:
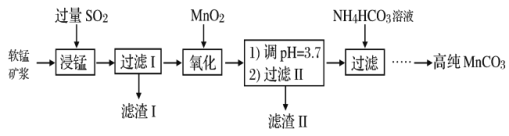
(1)浸锰过程中Fe2O3与SO2反应的离子方程式为Fe2O3+SO2+2H+=2Fe2++SO42-+H2O,该反应是经历以下两步反应实现的。
i.Fe2O3+6H+=2Fe3++3H2O ii.……
写出ii的离子方程式:______________________。
(2)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为___________(填离子符号)
(3)氧化过程中被MnO2氧化的物质有(写化学式):______________________。
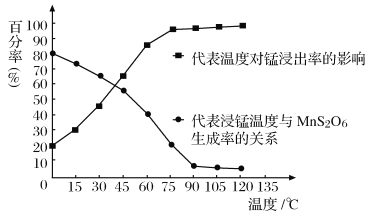
(4)“浸锰”反应中往往有副产物MnS2O6生成,温度对浸锰”反应的影响如图所示:为减少MnS2O6的生成,“浸锰”的适宜温度是___________;向过滤Ⅱ所得的滤液中加入NH4HCO3溶液时温度不宜太高的原因是______________________。
(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有气体生成,写出反应的离子方程式:______________________。
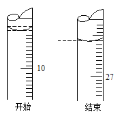
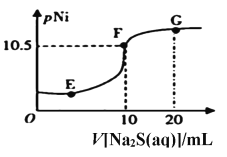
(6)已知:pNi=-lgc(Ni2+),常温下,Ksp(NiCO3)=1.4×10-7,向10mL0.1mol·L-1Ni(NO3)2溶液中滴加0.1mol·L-1Na2S溶液,会产生NiS沉淀,在滴加过程中pNi与Na2S溶液体积的关系如图所示。则在E、F、G三点中,___________点对应溶液中水电离程度最小,常温下,在NiS和NiCO3的浊液中![]() =______________________。
=______________________。
【答案】2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ Mn2+ 、Fe2+ SO2(H2SO3、SO32-)、FeSO4(Fe2+) 90℃ 防止NH4HCO3受热分解,以提高原料利用率 Mn2++2HCO3-=MnCO3↓+CO2↑+ H2O F 1.4×1014
【解析】
软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3):由流程可知软锰矿形成矿浆,通入过量的SO2,发生反应,MnO2+SO2=MnSO4,Fe2O3+SO2+2H+=2Fe2++SO42-+H2O,SiO2不反应,过滤,滤渣I为,滤液含有Mn2+、Fe2+,加入二氧化锰氧化亚铁离子,反应为:2Fe2++15MnO2+28H+=2Fe3++14H2O+15Mn2++4SO42-,调节pH,沉淀铁离子,过滤,滤渣II为氢氧化铁,向滤液中加入碳酸氢铵溶液,生成MnCO3沉淀,过滤得到的滤渣中主要含有MnCO3,反应为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O,通过洗涤、烘干得到MnCO3晶体,据此分析解答。
(1)Fe3+与SO2和水反应,生成Fe2+、SO42-和H+,离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,
故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
(2)浸锰过程中发生反应:MnO2+SO2=MnSO4、Fe2O3+SO2+2H+=2Fe2++SO42-+H2O,所以过滤Ⅰ所得滤液中主要存在的两种金属阳离子为Mn2+ 、Fe2+,
故答案为:Mn2+ 、Fe2+;
(3)氧化过程中加入MnO2的目的为除去过量的SO2,生成MnSO4;同时MnO2也可以氧化FeSO4,
故答案为:SO2、FeSO4;
(4)由图像可知,90℃时MnS2O6的生成速率相对较低,锰的浸出率相对较高,若温度升高,MnS2O6的生成速率及锰的浸出率变化均不明显,却会消耗更多的能源,所以“浸锰”的适宜温度是90℃;温度过高时,NH4HCO3受热易分解为NH3、CO2和H2O,导致原料利用率降低,
故答案为:90℃;防止NH4HCO3受热分解,以提高原料利用率;
(5)加入NH4HCO3溶液后,Mn2+与HCO3-反应生成MnCO3沉淀,同时还有CO2气体生成,反应的离子方程式为Mn2++2HCO3-=MnCO3↓+CO2↑+ H2O,
故答案为:Mn2++2HCO3-=MnCO3↓+CO2↑+ H2O;
(6)硝酸镍是强酸弱碱盐,硫化钠是强碱弱酸盐,它们都能促进水的电离。F点表示硝酸镍和硫化钠恰好完全反应,溶液中溶质是硝酸钠,水的电离程度最小;
由图可知,F点表示硝酸镍和硫化钠恰好完全反应,溶液中c(Ni2+)=c(S2-)=10-10.5mol/L,
则Ksp(NiS)=10-10.5×10-10.5=10-21,
NiCO3(s)+S2-(aq)![]() NiS(s)+CO32-(aq), K=
NiS(s)+CO32-(aq), K=![]() =
=![]() =
=![]() =1.4×1014,
=1.4×1014,
故答案为:F;1.4×1014。

 阅读快车系列答案
阅读快车系列答案