题目内容
在1.0L密闭容器中放入0.10molA(g),在一定温度进行如下反应:A(g)?B(g)+C(g )△H=+85.1kJ?mol-1
反应时间(t)与容器内气体总压强(p)的数据见下表:
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为 .
(2)由总压强p和起始压强p0计算反应物A的转化率α(A)的表达式为 ,
平衡时A的转化率为 ,列式并计算反应的平衡常数K .
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),n总= mol,n(A)= mol.
②下表为反应物A浓度与反应时间的数据,计算:α= .
分析该反应中反应物的浓度c(A)变化与时间间隔(△t)的规律,得出的结论是 ,由此规律推出反应在12h时反应物的浓度c(A)为 mol?L-1.
反应时间(t)与容器内气体总压强(p)的数据见下表:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
(1)欲提高A的平衡转化率,应采取的措施为
(2)由总压强p和起始压强p0计算反应物A的转化率α(A)的表达式为
平衡时A的转化率为
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),n总=
②下表为反应物A浓度与反应时间的数据,计算:α=
| 反应时间t/h | 0 | 4 | 8 | 16 |
| c(A)/(mol?L-1) | 0.10 | a | 0.026 | 0.0065 |
分析:(1)反应是吸热反应,反应前后气体体积增大,结合平衡移动原理分析判断转化率;
(2)相同条件下压强之比等于物质的量之比,反应前后物质的量的增大是反应的A的物质的量,结合转化率概念计算得到;依据化学平衡三段式列式计算平衡浓度达到平衡常数;
(3)①依据相同条件下压强之比等于物质的量之比,结合平衡计算得到;
②依据平衡A的浓度计算,依据图表数据分析判断存在的规律;
(2)相同条件下压强之比等于物质的量之比,反应前后物质的量的增大是反应的A的物质的量,结合转化率概念计算得到;依据化学平衡三段式列式计算平衡浓度达到平衡常数;
(3)①依据相同条件下压强之比等于物质的量之比,结合平衡计算得到;
②依据平衡A的浓度计算,依据图表数据分析判断存在的规律;
解答:解:(1)在一定温度进行如下反应:A(g)?B(g)+C(g )△H=+85.1kJ?mol-1
反应是吸热反应,反应前后气体体积增大,根据平衡移动原理分析可知,欲提高A的平衡转化率,平衡正向进行,可以升温或减压条件下使平衡正向进行;
故答案:升高温度、降低压强;
(2)反应前后气体物质的量增大为反应的A的量,所以由总压强p和起始压强p0计算反应物A的转化率α(A)的表达式=
×100%=(
-1)×100%;
平衡时A的转化率=
×100%=94.1%
依据化学平衡三段式 列式得到;
A(g)?B(g)+C(g )
起始量(mol/L) 0.10 0 0
变化量(mol/L) 0.10×94.1% 0.10×94.1% 0.10×94.1%
平衡量(mol/L)0.10(1-94.1%) 0.10×94.1% 0.10×94.1%
K=
=
=1.5mol/L
故答案为:=(
-1)×100%;94.1%; 1.5mol/L
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),依据压强之比等于物质的量之比,n总:n起始=P:P0 ,n总=
;
A(g)?B(g)+C(g )
起始量(mol) 0.10 0 0
变化量(mol) x x x
平衡量(mol) 0.10-x x x
(0.10+x):0.10=P:P0
x=
n(A)=0.10-
=0.10×(2-
)mol;
故答案为:
;0.10×(2-
);
②n(A)=0.10×(2-
)=0.10×(2-
)=0.051mol所以浓度a=0.051mol/L;分析数据特征可知,每隔4h,A的浓度减小一半,故答案为:0.051;达到平衡前每间隔4h,c(A)减少约一半;由此规律推出反应在12h时反应物的浓度c(A)=
=0.013mol/L;
故答案为:0.051,每隔4h,A的浓度减小一半;0.013;
反应是吸热反应,反应前后气体体积增大,根据平衡移动原理分析可知,欲提高A的平衡转化率,平衡正向进行,可以升温或减压条件下使平衡正向进行;
故答案:升高温度、降低压强;
(2)反应前后气体物质的量增大为反应的A的量,所以由总压强p和起始压强p0计算反应物A的转化率α(A)的表达式=
| P-P0 |
| P0 |
| P |
| P0 |
平衡时A的转化率=
| 9.53-4.91 |
| 4.91 |
依据化学平衡三段式 列式得到;
A(g)?B(g)+C(g )
起始量(mol/L) 0.10 0 0
变化量(mol/L) 0.10×94.1% 0.10×94.1% 0.10×94.1%
平衡量(mol/L)0.10(1-94.1%) 0.10×94.1% 0.10×94.1%
K=
| c(B)c(C) |
| c(A) |
| (0.0941mol/L)2 |
| 0.10×(1-94.1%) |
故答案为:=(
| P |
| P0 |
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),依据压强之比等于物质的量之比,n总:n起始=P:P0 ,n总=
| 0.10P |
| P0 |
A(g)?B(g)+C(g )
起始量(mol) 0.10 0 0
变化量(mol) x x x
平衡量(mol) 0.10-x x x
(0.10+x):0.10=P:P0
x=
| 0.10(P-P0) |
| P0 |
n(A)=0.10-
| 0.10(P-P0) |
| P0 |
| p |
| p0 |
故答案为:
| 0.10P |
| P0 |
| p |
| p0 |
②n(A)=0.10×(2-
| p |
| p0 |
| 7.31 |
| 4.91 |
| 0.026mol/L |
| 2 |
故答案为:0.051,每隔4h,A的浓度减小一半;0.013;
点评:本题考查压强关系和物质的量的计算应用,化学平衡计算方法,图表数据处理方法的分析判断,题目难度中等.

练习册系列答案
相关题目
一定温度下,向1.0L密闭容器中加入0.60molX(g),发生反应X(g)  Y(s)+2Z(g)△H>0测得反应物X浓度与反应时间的数据如下表
Y(s)+2Z(g)△H>0测得反应物X浓度与反应时间的数据如下表
|
反应时间t/min |
0 |
1 |
2 |
3 |
4 |
6 |
8 |
|
c(X)/(mol·L-1) |
0.60 |
0.42 |
0.30 |
0.21 |
0.15 |
a |
0.0375 |
(1)3min时用Z表示的平均反应速率v(Z)= 。
(2)分析该反应中反应物的浓度与时间的规律,得出的结论是 。由此规律推出反应在6min时反应物的浓度a为 mol·L-1。
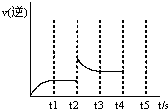
(3)反应的逆反应速率随时间变化的关系如图,t2时改变了某一种条件,改变的条件可能是 、 (填写两顶)

(4)下列哪些情况表明容器中已达平衡状态 (填字母序号)
A.容器体积一定时气体密度不再变化
B.反应的平衡常数不再变化
C.容器中气体的平均相对分子质量不随时间而变化
D.Y的物质的量不再发生变化
E.Z的生成速率等于X的消耗速率的2倍