题目内容
【题目】现有以下有机物:
①CH3CHO②CH3CH2OH③CH3COOH④CH3COOC2H5
(1)能与Na反应的是______________;
(2)能与NaOH溶液反应的有______________;
(3)既能发生消去反应,又能发生酯化反应的有______________;
(4)能发生银镜反应的有______________;并写出化学方程式:______________
(5)能与NaHCO3溶液反应有气泡产生的是_______________;并写出化学方程式:______________。
【答案】②③ ③④ ② ① CH3CHO+2Ag(NH3)2OH![]() CH3COONH4+2Ag↓+3NH3+H2O ③ CH3COOH+NaHCO3= CH3COONa+H2O+CO2
CH3COONH4+2Ag↓+3NH3+H2O ③ CH3COOH+NaHCO3= CH3COONa+H2O+CO2![]()
【解析】
(1)羟基和羧基都能和钠反应;
(2)羧基和酯基能和NaOH反应;
(3) 乙醇能发生消去反应和酯化反应;
(4)含有醛基的有机物能和银氨溶液反应;
(5) 羧基能和碳酸氢钠反应生成二氧化碳。
(1)羟基和羧基都能和钠反应,符合条件的是②③,
故答案为:②③;
(2)酚羟基和羧基、酯基、肽键能和NaOH反应,符合条件的是③④,
故答案为:③④;
(3)醇能发生酯化反应、连接醇羟基的碳原子相邻碳原子上含有氢原子的醇能发生消去反应,符合条件的是②;
故答案为:②;
(4)含有醛基的有机物能和银氨溶液反应,符合条件的是①,反应的化学方程式为:CH3CHO+2Ag(NH3)2OH![]() CH3COONH4+2Ag↓+3NH3+H2O;
CH3COONH4+2Ag↓+3NH3+H2O;
故答案为:①;CH3CHO+2Ag(NH3)2OH![]() CH3COONH4+2Ag↓+3NH3+H2O;
CH3COONH4+2Ag↓+3NH3+H2O;
(5)羧基能和碳酸氢钠反应生成二氧化碳,符合条件的是③,乙酸和碳酸氢钠反应的化学方程式为:CH3COOH+NaHCO3= CH3COONa+H2O+CO2![]() ;
;
故答案为:③;CH3COOH+NaHCO3= CH3COONa+H2O+CO2![]() 。
。

【题目】醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷和1—溴丁烷的反应如下:
NaBr+H2SO4HBr+NaHSO4 ①
R—OH+HBr![]() R—Br+H2O ②
R—Br+H2O ②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br—被浓硫酸氧化为Br2等。有关数据列表如下;
乙醇 | 溴乙烷 | 正丁醇 | 1—溴丁烷 | |
密度/g·cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
请回答下列问题:
(1)溴乙烷和1—溴丁烷的制备实验中,下列仪器最不可能用到的是________。(填字母)
a.圆底烧瓶 b.量筒 c.锥形瓶 d.长颈漏斗
(2)溴代烃的水溶性______(填“大于”、“等于”或“小于”)相应的醇,将1-溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在______(填“上层”、“下层”或“不分层”)
(3)制备操作中,加入的浓硫酸必需进行稀释,其目的是____________。(填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(4)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是____________。(填字母)
a.NaI b.NaOH c.NaHSO3 d.KCl
(5)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于______________ ;
但在制备1—溴丁烷时却不能边反应边蒸出产物,其原因是_______________________。
(6)得到的溴乙烷中含有少量乙醇,为了制得纯净的溴乙烷,可用蒸馏水洗涤,分液后,再加入无水CaCl2后进行的实验操作是______(填字母)
a.分液 b.蒸馏 c.萃取 d.过滤
(7)为了检验溴乙烷中含有溴元素,通常采用的方法是取少量溴乙烷,然后______(按实验的操作顺序选填下列序号)①加热 ②加入AgNO3 ③加入稀HNO3 ④加入NaOH溶液.
【题目】某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等),下列分析推理正确的是
50mL盐酸 | 50mL盐酸 | 50mL盐酸 | |
m(混合物) | 9.2g | 15.7g | 27.6g |
| 2.24L | 3.36L | 3.36L |
A.盐酸的物质的量浓度为5.0mol·L-1
B.根据表中数据计算出混合物中NaHCO3的物质的量分数为50%
C.9.2g混合物中NaHCO3和KHCO3分别为5.0g和4.2g
D.15.7g混合物恰好与盐酸完全反应
【题目】保护环境已成为当前和未来的一项全球性重大课题.为解决目前燃料使用过程中的环境污染问题,并缓解能源危机,有的专家提出利用太阳能促使燃料循环使用的构想,如图所示:
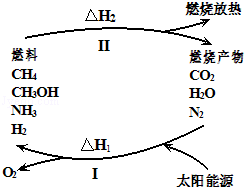
过程I可用如下反应表示:
①2CO2![]() 2CO+O2
2CO+O2
②2H2O![]() 2H2+O2
2H2+O2
③2N2+6H2O![]() 4NH3+3O2
4NH3+3O2
④2CO2+4H2O![]() 2CH3OH+3O2
2CH3OH+3O2
⑤2CO+H2O![]() +3O2
+3O2
请回答下列问题:
(1)过程I的能量转化形式为: 能转化为 能.
(2)请完成第⑤个反应的化学方程式
(3)上述转化过程中,△H1和△H2的关系是
(4)断裂1mol化学键所需的能量见表:
共价键 | H﹣N | H﹣O | N≡N | O=O |
断裂1mol化学键所需能量/kJmol﹣1 | 393 | 460 | 941 | 499 |
常温下,N2和H2O反应生成NH3的热化学方程式为