题目内容
9.在不同条件下,镁跟碳可生成两种金属碳化物:Mg2C3和Mg3C2,取物质的混合物置于水中,反应所生成的气态产物中有( )| A. | CH4 | B. | C2H6 | C. | C2H2 | D. | C3H4 |
分析 根据CaC2+2H2O=Ca(OH)2+C2H2解题,反应过程中元素化合价不发生变化,据此书写生成的烃的化学式;
解答 解:根据CaC2+2H2O=Ca(OH)2+C2H2,可知Mg2C3+4H2O=2Mg(OH)2+C3H4,C3H4的结构简式为CH3C≡CH,Mg3C2+6H2O=3Mg(OH)2+C2H6,
故选BD.
点评 本题考查炔烃的生成,注意类比迁移思想的应用,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
19.化学与生活息息相关,下列说法正确的是( )
| A. | 氧化钙和铁粉常用作食品干燥剂 | |
| B. | 14C可用于文物年代的鉴定,14C与12C互为同素异形体 | |
| C. | 碳酸钡不溶于水因此在医疗上用作钡餐 | |
| D. | “血液透析”利用了胶体的性质 |
20.下列化合物分子中所有原子一定处于同一平面的是( )
| A. | 甲苯 | B. | 1-丁烯 | C. | 溴苯 | D. | 丙烯 |
17.利用如图装置,可以模拟铁的电化学防护.下列关于该装置的叙述中正确的是( )
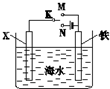

| A. | 若X为Zn时,则开关K置于M或N时均可减缓铁的腐蚀 | |
| B. | 若X为Cu时,为减缓铁的腐蚀,开关K应置于M处 | |
| C. | 若X为石墨、开关K置于M时,X电极上的反应为2H++2e-=H2↑ | |
| D. | 若X为石墨、开关K置于N时,铁电极上的反应为Fe-2e-=Fe2+ |
4.下列说法正确的是( )
| A. | 原电池的正极和电解池的阴极所发生的反应分别是氧化反应、还原反应 | |
| B. | 温度不变,用惰性电极电解饱和碳酸钠溶液,通电一段时间,溶液的浓度不变,有晶体析出 | |
| C. | 用惰性电极电解CuCl2溶液,一段时间后,要恢复原来的浓度,应加入固体CuSO4 | |
| D. | 以惰性电极电解CuSO4溶液,若阳极上产生的气体的物质的量为0.010mol,则阴极上析出Cu的质量为12.8g |
14.下列各组离子在给定条件下能大量共存的是( )
| A. | 在pH=1溶液中:NH4+、K+、HS-、Cl- | |
| B. | 有SO42-存在的溶液中:Na+、Mg2+、Ca2+、I- | |
| C. | 使酚酞试液变红的溶液中:Na+、Cl-、SO${\;}_{4}^{2-}$、Fe3+ | |
| D. | 无色透明的水溶液中:K+、Ba2+、I-、NO${\;}_{3}^{-}$ |
1.下列关于摩尔的说法中,正确的是( )
| A. | 摩尔是表示物质质量的单位 | |
| B. | 摩尔是国际七个基本物理量之一 | |
| C. | 用摩尔表示物质的量时,要用化学式指明粒子种类 | |
| D. | 摩尔既是物质的量的单位,又是粒子的数量单位 |
18.下列说法正确的是( )
| A. | 22.4LCO中一定含有6.02×1023个分子 | |
| B. | 44gCO2在标准状况下的体积约为22.4L | |
| C. | 将40gNaOH溶于1L水中.所得溶液中NaOH的物质的量浓度为1mol/L | |
| D. | 在标准状况下,20mL NH3与60mLO2所含的分子数之比为1:3 |
15.柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4•7H2O)通过下列反应制备:FeSO4+Na2CO3═FeCO3↓+Na2SO4;FeCO3+C6H8O7═FeC6H6O7+CO2↑+H2O.
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
(1)制备FeCO3时,选用的加料方式是c(填字母),原因是避免生成Fe(OH)2沉淀.
a.将FeSO4溶液与Na2CO3溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是取最后一次的洗涤滤液1~2mL于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净.
(3)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80℃下搅拌反应.
①铁粉的作用是防止+2价的铁元素被氧化.
②反应结束后,无需过滤,除去过量铁粉的方法是加入适量柠檬酸让铁粉反应完全.
(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体.分离过程中加入无水乙醇的目的是降低柠檬酸亚铁在水中的溶解量,有利于晶体析出.
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
a.将FeSO4溶液与Na2CO3溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是取最后一次的洗涤滤液1~2mL于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净.
(3)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80℃下搅拌反应.
①铁粉的作用是防止+2价的铁元素被氧化.
②反应结束后,无需过滤,除去过量铁粉的方法是加入适量柠檬酸让铁粉反应完全.
(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体.分离过程中加入无水乙醇的目的是降低柠檬酸亚铁在水中的溶解量,有利于晶体析出.