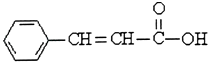题目内容
【题目】关于热化学方程式:2H2(g)+O2(g)=2H2O(1),H=﹣571.6kJmol﹣1 , 下列叙述正确的是( )
A.2mol气态H2与1mol气态氧气完全燃烧生成2mol液态水时放出571.6 kJ的热量
B.1mol气态H2与0.5mol气态氧气完全燃烧生成1mol液态水时吸收285.8kJ的热量
C.2个氢分子完全燃烧生成液态水时放出571.6 kJ的热量
D.上述热化学方程式可表示为H2(g)+O2(g)=H2O(1),H=﹣285.8 kJmol﹣1
【答案】A
【解析】解:热化学方程式的化学计量数只表示物质的量,不表示分子个数,可以是整数也可以是分数,注意△H的数值与化学计量数的统一.A、由2H2(g)+02(g)═2H20(1),△H=﹣571.6kJmol﹣1知,故A正确;
B、1mol氢气燃烧放热是2mol氢气燃烧放热的一半,而不是吸热,故B错误;
C、热化学方程式中的化学计量数指表示物质的量不表示分子个数,故C错误;
D、热化学方程式2H2(g)+02(g)═2H20(1),△H=﹣571.6kJmol﹣1 , 化学计量数除以2可得H2(g)+ ![]() O2(g)=H2O(1),H=﹣285.8 kJmol﹣1 , 故D错误;
O2(g)=H2O(1),H=﹣285.8 kJmol﹣1 , 故D错误;
故选:A.
【考点精析】解答此题的关键在于理解反应热和焓变的相关知识,掌握在化学反应中放出或吸收的热量,通常叫反应热.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目