题目内容
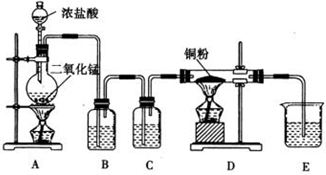
如图1是某研究性学习小组利用实验室制氯气的装置设计制取氯水并进行相关实验.
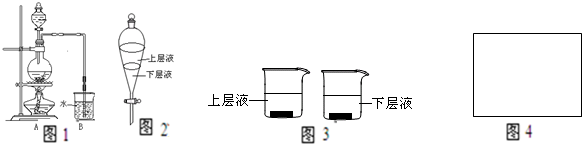
(1)A装置中发生化学反应的离子方程式为______.
(2)氯气能使湿润的红色布条褪色.对于使红色布条褪色的物质,同学们的看法不一致,认为氯水中存在的几种粒子都有可能.请你设计实验,得出正确结论.
①提出假设假设一______.假设二______.假设三______.假设四H2O使布条褪色
②设计实验方案
基于提出的假设,设计出实验方案(不需要作答)
③实验过程
实验①:______;实验②:______.实验③:把红色布条放在水里,布条不褪色.
④得出结论______.
(3)用量筒取20mL氯水,倒入已检查完好的分液漏斗中,然后再注入10mLCCl4,盖好玻璃塞,振荡,静置于铁架台上(如图2),等分层后取上层液和下层液,呈黄绿色的是______(填“上层液”或“下液”),再装入如图3所示的烧杯中,能使有色布条褪色的是______(填“上层液”或“下层液”)
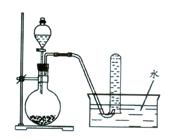
(4)上述制备并吸收氯气装置的缺点是______,如何改进______,在图4框中画出改进的实验装置图______.

(1)A装置中发生化学反应的离子方程式为______.
(2)氯气能使湿润的红色布条褪色.对于使红色布条褪色的物质,同学们的看法不一致,认为氯水中存在的几种粒子都有可能.请你设计实验,得出正确结论.
①提出假设假设一______.假设二______.假设三______.假设四H2O使布条褪色
②设计实验方案
基于提出的假设,设计出实验方案(不需要作答)
③实验过程
实验①:______;实验②:______.实验③:把红色布条放在水里,布条不褪色.
④得出结论______.
(3)用量筒取20mL氯水,倒入已检查完好的分液漏斗中,然后再注入10mLCCl4,盖好玻璃塞,振荡,静置于铁架台上(如图2),等分层后取上层液和下层液,呈黄绿色的是______(填“上层液”或“下液”),再装入如图3所示的烧杯中,能使有色布条褪色的是______(填“上层液”或“下层液”)
(4)上述制备并吸收氯气装置的缺点是______,如何改进______,在图4框中画出改进的实验装置图______.
(1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、水和氯气,氧化物、气体、弱电解质写化学式,可溶性的强电解质写离子式,反应的离子方程式为:MnO2+4H++2C1-
Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2C1-
Mn2++Cl2↑+2H2O;
(2)①氯水中含有氯气、盐酸、水和次氯酸,可分别根据这四种物质进行实验设计,提出假设假设一:盐酸能使红色布条退色;假设二:氯气使红色布条退色;假设三:HClO能使布条退色;假设四 H2O使布条褪色,
故答案为:盐酸能使红色布条退色;氯气使红色布条退色;HClO能使布条退色;
③实验①:用玻璃棒蘸取稀盐酸滴到红色布条上,红色布条不退色,说明盐酸没有漂白作用;实验②:用把干燥的红色布条放入充满氯气的集气瓶中,红色布条不退色,说明氯气没有漂白作用;实验③:把红色布条放在水里,布条不褪色,
故答案为:用玻璃棒蘸取稀盐酸滴到红色布条上,红色布条不退色,说明盐酸没有漂白作用;把干燥的红色布条放入充满氯气的集气瓶中,红色布条不退色,说明氯气没有漂白作用;
④次氯酸具有强氧化性和漂白性,可使红色布条褪色,
故答案为:次氯酸使红色布条退色;
(3)氯气易溶于四氯化碳,四氯化碳密度大于水的密度,所以呈黄绿色的为下层液;由于氯气能够使有色布条褪色,上层液中有次氯酸,所以使有色布条褪色的是上层液,
故答案为:下层液;上层液;
(4)氯气不能直接排放到空气中,应加入尾气处理装置,因氯气可与氢氧化钠反应,则尾气处理装置用氢氧化钠溶液,改进的实验装置图为: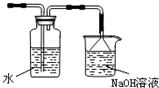 ,
,
故答案为:会造成环境污染;增加尾气吸收装置; .
.
| ||
故答案为:MnO2+4H++2C1-
| ||
(2)①氯水中含有氯气、盐酸、水和次氯酸,可分别根据这四种物质进行实验设计,提出假设假设一:盐酸能使红色布条退色;假设二:氯气使红色布条退色;假设三:HClO能使布条退色;假设四 H2O使布条褪色,
故答案为:盐酸能使红色布条退色;氯气使红色布条退色;HClO能使布条退色;
③实验①:用玻璃棒蘸取稀盐酸滴到红色布条上,红色布条不退色,说明盐酸没有漂白作用;实验②:用把干燥的红色布条放入充满氯气的集气瓶中,红色布条不退色,说明氯气没有漂白作用;实验③:把红色布条放在水里,布条不褪色,
故答案为:用玻璃棒蘸取稀盐酸滴到红色布条上,红色布条不退色,说明盐酸没有漂白作用;把干燥的红色布条放入充满氯气的集气瓶中,红色布条不退色,说明氯气没有漂白作用;
④次氯酸具有强氧化性和漂白性,可使红色布条褪色,
故答案为:次氯酸使红色布条退色;
(3)氯气易溶于四氯化碳,四氯化碳密度大于水的密度,所以呈黄绿色的为下层液;由于氯气能够使有色布条褪色,上层液中有次氯酸,所以使有色布条褪色的是上层液,
故答案为:下层液;上层液;
(4)氯气不能直接排放到空气中,应加入尾气处理装置,因氯气可与氢氧化钠反应,则尾气处理装置用氢氧化钠溶液,改进的实验装置图为:
 ,
,故答案为:会造成环境污染;增加尾气吸收装置;
 .
.
练习册系列答案
相关题目