题目内容
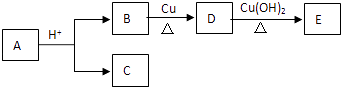
【题目】化学工业生产上容易产生工业“三废”,'变废为宝,探索利用是化学必需要完成的.某工厂的工此废料中含有铜、铝、铁,可利用其制备CuSO45H2O、Fe SO47H2O和AlCl3过程如图: 
(1)将AlCl3溶液蒸干并灼烧,得到的产物是 .
(2)写出A→C的化学方程式: .
(3)检验滤液D中的金属阳离子的方法:
(4)写出E→CuSO4的化学方程式: .
(5)写出废料与烧碱反应的离子方程式: .
(6)取少量滤液D,向其中加入双氧水,现象为: .
(7)用CuSO4溶液作粗铜的精炼液,阴极上发生的电极反应式为: .
(8)钠和铝都是活泼金属,写出工此生产钠的化学方程式: .
【答案】
(1)Al2O3
(2)NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
(3)取少量D溶液于试管中,滴加KSCN溶液,无现象,再滴加新制氯水,溶液变成血红色,有Fe2+存在
(4)2Cu+2H2SO4+O2=2CuSO4+2H2O
(5)2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑
(6)溶液变为黄色
(7)Cu2++2e﹣=Cu
(8)2NaCl ![]() 2Na+Cl2↑
2Na+Cl2↑
【解析】解:(1)氯化铝溶液中,铝离子水解生成氢氧化铝和氢离子,导致溶液显示酸性,实质是:Al3++3H2OAl(OH)3+3H+ , 把AlCl3溶液蒸干灼烧,水解平衡向右移动,生成氢氧化铝,同时盐酸挥发,最后得到的主要固体产物是氢氧化铝,受热分解生成氧化铝和水,
所以答案是:Al2O3;(2)偏铝酸钠溶液中通入过量的二氧化碳的反应:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3;
所以答案是:NaAlO2+CO2+2H2O=Al (OH)3↓+NaHCO3;(3)滤液D为氯化亚铁溶液,检验Fe2+的方法是:取少量D溶液于试管中,滴加KSCN溶液,无现象,再滴加新制氯水,溶液变成血红色,有Fe 2+存在.
所以答案是:取少量D溶液于试管中,滴加KSCN溶液,无现象,再滴加新制氯水,溶液变成血红色,有Fe 2+存在;(4)滤渣F为铜单质,转化成胆矾的方法是在滤渣F中加入硫酸再通入热空气反应成CuSO4溶液,化学方程式为2Cu+2 H2SO4+O2=2CuSO4+2 H2O;
所以答案是:2Cu+2 H2SO4+O2=2CuSO4+2 H2O;(5)废料中有Al,Al为两性元素,Al溶于NaOH溶液的离子方程式为2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑,
所以答案是:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑;(6)滤液D为氯化亚铁溶液,加入双氧水将把Fe2+氧化为Fe3+ , 故溶液由浅绿色变为黄色,
所以答案是:溶液变为黄色;(7)用CuSO4溶液作粗铜的精炼液,阴极上发生的电极反应式为还原反应,Cu2++2e﹣=Cu,
所以答案是:Cu2++2e﹣=Cu;(8)工业上生产钠是用电解熔融的NaCl可得Na:2NaCl ![]() 2Na+Cl2↑,
2Na+Cl2↑,
所以答案是:2NaCl ![]() 2Na+Cl2↑.
2Na+Cl2↑.