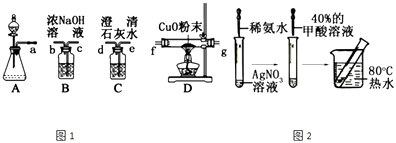
��Ŀ����
����Ŀ����ҵ������������ﮣ���������������þ���Ʊ��ķ�������������£�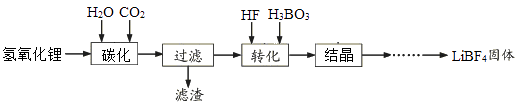
��֪��̼���������ˮ
��1��̼��ʱ��������Ҫ���ӷ���ʽΪ����������Ҫ�ɷ�����(д��ѧʽ)
��������ɴ�ѡ�������������CO2 �� �����ü۸�����˵��������ƣ�����Ҫԭ����
��2��ת�����̷����ķ�ӦΪ�������������ֱ�ΪLiHCO3+HF=LiF��3HF+H2O����д��ѧ����ʽ�����ù����в��ܲ��ò���������ԭ��Ϊ��
��3���ᾧ�õ��ľ���LiBF4��H2O������20�桪50��������150������150������Ŀ������
���𰸡�
��1��LiOH+CO2=Li++HCO3- ��Mg(OH)2��������ͬ��������̼�����������������
��2��LiF��3HF+ H3BO3= LiBF4+ 3H2O��HF ��ʴ����
��3�������ᾧˮ
���������⣺��1����������ȷ��̼��Ŀ����ʹ���ܵ��������ת��Ϊ������ˮ��̼����ﮣ����Է���ʽΪLiOH+CO2=Li++HCO3-;̼��ʱ�������ת��Ϊ̼������ܽ⣬������þ��̼���θ����ܣ������õ�������þ����;�ɴ�Ҫ������Խ��Խ�ã�������ͬ��������̼���������������������������;(2)��Ϊ��Ӧ����������������һ���IJ����ǵڶ����ķ�Ӧ����������յIJ�Ʒ��LiF.3HF+H3BO3=LiBF4+3H2O����Ӧ����HF���룬���ܸ�ʴ���������Բ����ò�������3�������нᾧ�õ��ľ�����нᾧˮ�����ջ����ˮ���壬����Ӧ�ȵ��¸����ȥ����ˮ�֣��ټ��ȳ�ȥ�ᾧˮ��