题目内容
【题目】CO2是一种常用的化工原料,可应用于化学和食品加工过程的惰性保护、焊接气体、植物生长刺激剂,在铸造中用于硬化模和芯子及用于气动器件,还应用于杀菌气的稀释剂。请回答下列问题:
I.我国中科院研究所利用CO2与环氧丙烷(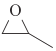 )合成生物降解聚碳酸酯(PPC)和聚(碳酸酯-醚)多元醇,则环氧丙烷中碳元素的平均化合价为____,CO2 的结构式为_________。
)合成生物降解聚碳酸酯(PPC)和聚(碳酸酯-醚)多元醇,则环氧丙烷中碳元素的平均化合价为____,CO2 的结构式为_________。
II.CO2 与H2反应可用于生产甲醇
(1)已知氢气与甲醇的燃烧热分别为a kJ·mol-1、b kJ·mol-1 , H2O(g)= H2O(l) △H=c kJ·mol-1 ,CH3OH(g)=CH3OH(l) H=d kJ·mol-1,则CO2与H2反应产生气态甲醇与气态水的热化学方程式为__________________________。
(2)取一定体积的CO2和H2的混合气体,加入恒容密闭容器中,发生上述反应,相同时间内,测得甲醇的体积分数![]() (CH3OH)与反应温度T的关系如图1所示,则该反应的
(CH3OH)与反应温度T的关系如图1所示,则该反应的![]() (CH3OH)随反应温度T变化的原因为_______________。
(CH3OH)随反应温度T变化的原因为_______________。
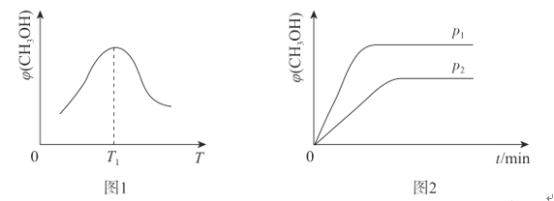
(3)温度为T时,向体积分别为V1、V2的甲.乙两容器中充人相同量的CO2和H2的混合气体,经过一段时间两容器均达到平衡,测得压强分别为p1、p2,如图2所示,则p1_____(填“>”“<”或“=”)p2。
(4)一定温度下,在1 L的密闭容器中,充入1 mol CO2和3 mol H2,压强为p0 kPa,发生上述反应,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
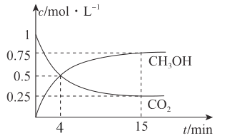
①反应进行到4 min 时,v(正)________ (填“>”“<"或“=”)v(逆)。0~4 min,H2 的平均反应速率v(H2)=______ mol· L-1·min- 1。
②CO2平衡时的体积分数为____________,该温度下Kp=________ (可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压代替平衡浓度计算,分压=总压×物质的量分数
【答案】![]() O=C=O CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H=(b-3a-c-d)kJ·mol-1 一定时间内,当温度低于T1时,反应未达到平衡,随着温度升高,反应速率增大,甲醇的体积分数增大;当温度大于T1时,反应达到平衡状态,因该反应为放热反应,随着温度升高,平衡逆向进行,甲醇的体积分数减小 > > 0.375 10%
O=C=O CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H=(b-3a-c-d)kJ·mol-1 一定时间内,当温度低于T1时,反应未达到平衡,随着温度升高,反应速率增大,甲醇的体积分数增大;当温度大于T1时,反应达到平衡状态,因该反应为放热反应,随着温度升高,平衡逆向进行,甲醇的体积分数减小 > > 0.375 10% ![]()
【解析】
I.利用有机物中O为-2价,H为+1价,然后根据化合价代数和为0,得出C的价态;CO2分子中C和O共用两个电子对;
II.(1)写出氢气、甲醇燃烧热的热化学反应方程式,再根据水状态、甲醇状态的变化,最后根据盖斯定律得出结果;
(2)T1点,甲醇的体积分数达到最大,说明反应达到平衡,小于T1时,反应没有达到平衡,大于T1时,从影响化学平衡移动的角度进行分析;
(3)图2中先达到平衡,说明压强大;
(4)①4min后,甲醇物质的量浓度增大,说明未达到平衡,反应向正反应方向移动;根据化学反应速率的数学表达式进行计算;
②利用“三段式法”计算CO2的平衡时的体积分数和Kp;
I.根据环氧丙烷的结构式,推出其分子式为C3H6O,O为-2价,H为+1价,化合价代数和为0,C的平均价态为![]() ;C和O之间共用2个电子对,CO2的结构式为O=C=O;
;C和O之间共用2个电子对,CO2的结构式为O=C=O;
II.(1)H2燃烧热的热化学反应方程式为H2(g)+![]() O2(g)=H2O(l) △H1=-akJ·mol-1 ①;CH3OH(l)+
O2(g)=H2O(l) △H1=-akJ·mol-1 ①;CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H2=-bkJ·mol-1 ②;H2O(g)=H2O(l) △H3=ckJ·mol-1 ③;CH3OH(g)=CH3OH(l) △H4=dkJ·mol-1;CO2与H2反应生成甲醇与气态水的方程式为CO2+3H2=CH3OH+H2O,根据盖斯定律,有3×①-②-③-④得出:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H=(b-3a-c-d)kJ·mol-1;
O2(g)=CO2(g)+2H2O(l) △H2=-bkJ·mol-1 ②;H2O(g)=H2O(l) △H3=ckJ·mol-1 ③;CH3OH(g)=CH3OH(l) △H4=dkJ·mol-1;CO2与H2反应生成甲醇与气态水的方程式为CO2+3H2=CH3OH+H2O,根据盖斯定律,有3×①-②-③-④得出:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H=(b-3a-c-d)kJ·mol-1;
(2)由图1可知,相同时间内,测的甲醇体积分数随反应温度的升高先增大后减小,是因为一开始温度低时,反应未达到平衡,随着温度升高,反应速率增大,相同时间内生成的甲醇的量增大,当反应达到平衡后,由图可知该反应为放热反应,升高温度,平衡左移,相同时间内生成甲醇的量减少;
(3)根据图2相同温度下,甲容器中的反应先达到平衡,说明甲容器中的压强较大,即p1>p2;
(4)①根据图像反应进行到4min时,甲醇的物质的量继续增大,反应正向进行,即v(正)>v(逆);0~4min,消耗CO2的物质的量浓度为(1-0. 5)mol·L-1=0.5mol·L-1,此时消耗H2的物质的量浓度为1.5mol·L-1,根据化学反应速率的表达式v(H2)=![]() =0.375mol/(L·min);
=0.375mol/(L·min);
② 则CO2的体积分数为
则CO2的体积分数为![]() ×100%=10%;相同条件下,压强之比等于物质的量之比,即达到平衡时总压强为p=
×100%=10%;相同条件下,压强之比等于物质的量之比,即达到平衡时总压强为p=![]() p0
p0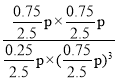 =
=![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】下列有关实验操作、实验现象和得出的结论均正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 将乙烯通入溴水中 | 溴水颜色褪去 | 乙烯具有还原性 |
B | 向5mL1mol·L-1的NaOH溶液中先滴入2滴1mol·L-1的MgCl2溶液,再滴入2滴1mol·L-1的FeCl3溶液 | 先有白色沉淀生成,后沉淀变为红褐色 | Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
C | 向BaCl2溶液中同时通入NH3和SO2气体 | 无沉淀生成 | H2SO3不能和BaCl2反应生成BaSO3和HCl |
D | 向盛有KI3溶液的试管中加入苯和AgNO3溶液 | 溶液分层,上层溶液变紫红色,下层有黄色沉淀生成 | KI3溶液中存在平衡:I3- |
A.AB.BC.CD.D