题目内容
将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g) 2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的反应平均速率为0.6 mol·L-1·s-1
②用物质B表示的反应的平均速率为0.15mol·L-1·s-1
③2s时物质A的转化率为30%
④2s时物质B的浓度为0.3 mol·L-1
其中正确的是
| A.①③ | B.①④ | C.②③ | D.③④ |
C
解析试题分析:经2 s后测得C的浓度为0.6 mol·L-1,则C物质表示的反应速率是0.6mol/L÷2s=0.3mol/(L·s),反应速率之比是相应的化学计量数之比,因此A物质表示的反应速率是0.3mol/(L·s),①不正确;反应速率之比是相应的化学计量数之比,因此B物质表示的反应速率是0.3mol/(L·s)÷2=0.15mol/(L·s),②正确;经2 s后测得C的浓度为0.6 mol·L-1,则根据方程式可知消耗A物质的浓度是0.6mol/L,A物质的起始浓度是2mol/L,所以2s时物质A的转化率为30%,③正确;B的起始浓度是1mol/L,根据方程式知,△c(B)=0.15mol/(L·s)×2s =0.3mol/L,所以2s时物质B的浓度为:1mol/L-0.3mol/L="0.7" mol/L,故④错误;故选C。
考点:考查化学平衡的计算、化学反应速率的计算

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案在一密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)  Ni(CO)4(g),已知该反应在25 ℃和80 ℃时的平衡常数分别为5×104、2。下列说法正确的是
Ni(CO)4(g),已知该反应在25 ℃和80 ℃时的平衡常数分别为5×104、2。下列说法正确的是
| A.恒温恒容下,向容器中再充入少量Ni(CO)4(g),达新平衡时,Ni(CO)4的百分含量将增大 |
| B.在80 ℃时,测得某时刻Ni(CO)4、CO浓度均为0.5 mol·L-1,则此时v(正)<v(逆) |
| C.恒温恒压下,向容器中再充入少量的Ar,上述平衡将正向移动 |
| D.上述生成Ni(CO)4(g)的反应为吸热反应 |
对可逆反应4NH3(g)+ 5O2(g)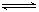 4NO(g)+ 6H2O(g),下列叙述正确的是
4NO(g)+ 6H2O(g),下列叙述正确的是
| A.达到化学平衡时,υ正=υ逆=0 |
| B.若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态 |
| C.达到化学平衡时,若增大容器体积,则正反应速率减少,逆反应速率增大 |
| D.达到化学反应平衡后,改变条件当υ正>υ逆,平衡向正反应方向移动 |
2SO2+O2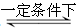 2SO3是制造硫酸的重要反应。下列关于该反应的说法正确的是
2SO3是制造硫酸的重要反应。下列关于该反应的说法正确的是
| A.使用催化剂不影响反应速率 |
| B.降低体系温度能加快反应速率 |
| C.增加O2的浓度能加快反应速率 |
| D.一定条件下达到反应限度时SO2全部转化为SO3 |
一定条件下将0.1 mol N2和0.3 mol H2置于密闭容器中发生反应N2+3H2 2NH3。下列关于该反应的说法正确的是
2NH3。下列关于该反应的说法正确的是
| A.最终可生成0.2 mol NH3 | B.使用催化剂不影响反应速率 |
| C.升高温度反应速率增大 | D.增大压强反应速率减小 |
已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| 温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
830℃时,向一个2 L的密闭容器中充入0.2mol的A和0.8mol的B,反应初始4 s内A的平均反应速率v(A)=0.005 mol/(L·s)。下列说法正确的是
A.4 s时c(B)为0.76 mol/L
B.830℃达平衡时,A的转化率为80%
C.反应达平衡后,升高温度,平衡正向移动
D.1200℃时反应C(g)+D(g)
 A(g)+B(g)的平衡常数的值为0.4
A(g)+B(g)的平衡常数的值为0.4 可逆反应2NO2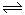 2NO+O2在体积不变的密闭容器中反应,达到平衡状态的标志是( )
2NO+O2在体积不变的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n molNO
②单位时间内生成n mol O2的同时生成2n molNO2
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
| A.①④ | B.②④ | C.①③④ | D.①②③④⑤ |
化学平衡常数可以用K来表示,下列关于化学平衡常数的说法中正确的是
| A.K越大,反应物的转化率越小 |
| B.K与反应物的浓度有关 |
| C.K与生成物的浓度有关 |
| D.K与温度有关 |
对可逆反应N2(g)+3H2(g) 2NH3(g),△H=-92.4 kJ.mol-1下列叙
2NH3(g),△H=-92.4 kJ.mol-1下列叙
述正确的是
| A.达到化学平衡时,若升高温度,则正反应速率减小,逆反应速率增大 |
| B.若单位时间内消耗x mol N2,同时生成2x mol NH3,则反应达到平衡状态 |
| C.若达到平衡时,共放出46.2kJ热量,则有l mo1NH3(g)生成 |
| D.达到平衡后,将容器体积减小为原来的一半,重新达到平衡后,c(NH3)变为原平衡时的2倍 |