题目内容
【题目】利用生活中常见的材料可以进行很多科学实验,甚至制作出一些有实际应用价值的装置来,如图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图.上述电池工作时,有关说法正确的是( ) 
A.铝罐将逐渐被腐蚀
B.碳粒和炭棒上发生的反应为:O2+4e﹣=2O2﹣
C.炭棒应与玩具电机的负极相连
D.该电池工作一段时间后炭棒和炭粒的质量会减轻
【答案】A
【解析】解:A、碳棒、铝罐和食盐水构成了原电池,较活泼的金属铝作负极,铝失电子生成铝离子,所以铝罐逐渐被腐蚀,故A正确;B、碳棒、铝罐和食盐水构成了原电池,较活泼的金属铝作负极,导电的非金属碳棒作正极,2H2O+O2+4e﹣=4OH﹣ , 故B错误;
C、碳棒作原电池的正极,所以应与玩具电机的正极相连,故C错误.
D、在原电池工作时,炭棒作正极,电极反应式为O2+2H2O+4e﹣=4OH﹣ , 由此可知炭棒和碳粒的质量不会改变,故D错误.
故选A.

【题目】表中,第Ⅰ栏和第Ⅱ栏的化学反应都可以用第Ⅲ栏的离子方程式表示的是( )
编号 | 第Ⅰ栏 | 第Ⅱ栏 | 第Ⅲ栏 |
A | H2SO4溶液中滴加Ba(OH)2至恰好沉淀完全 | 在NaHSO4溶液中滴加Ba(OH)2至中性 | H++SO |
B | 氢氧化钠溶液中通入过量CO2 | 氢氧化钙溶液中滴入过量CO2 | OH﹣+CO2═HCO |
C | 向碳酸氢铵溶液中加过量澄清石灰水 | 向碳酸氢钠溶液中加过量澄清石灰水 | HCO |
D | FeBr2溶液和少量Cl2反应 | FeI2溶液和少量Cl2反应 | 2Fe2++Cl2═2Fe3++2Cl﹣ |
A.A
B.B
C.C
D.D
【题目】实验室用少量的溴水和足量的乙醇制备1,2﹣二溴乙烷的装置如图所示: 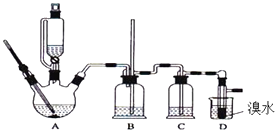
乙醇 | 1,2二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/gcm﹣3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | ﹣130 | 9 | ﹣116 |
请回答下列问题:
(1)写出制备1,2二溴乙烷的反应原理方程式:、
(2)在此制备实验中,要尽可能迅速地把反应温度升高到170℃左右,最主要的目的是(填序号).
a.引发反应 b.加快反应速度c.防止乙醇挥发 d.减少副产物乙醚生成
(3)装置B的作用是 .
(4)在装置C中应加入(填序号),其目的是吸收反应中可能生成的酸性气体.
a.水b.浓硫酸c.氢氧化钠溶液d.饱和碳酸氢钠溶液
(5)判断该制备反应已经结束的最简单方法是 .
(6)将1,2二溴乙烷粗产品置于分液漏斗中,加水振荡后静置,产物应在(填“上”或“下”)层.
(7)若产物中有少量副产物乙醚,可用的方法除去.
【题目】随着学技术的发展和环保要求的不断提高,CO2的捕集利用技术成为研究的重点.完成下列填空:
(1)目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:
CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
已知H2的体积分数随温度的升高而增加.若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化.(填“增大”、“减小”或“不变”)
v正 | v逆 | 平衡常数K | 转化率α |
(2)相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如表:
[CO2]/molL﹣1 | [H2]/molL﹣1 | [CH4]/molL﹣1 | [H2O]/molL﹣1 | |
平衡Ⅰ | a | b | c | d |
平衡Ⅱ | m | n | x | y |
a、b、c、d与m、n、x、y之间的关系式为 .
(3)碳酸:H2CO3 , Ki1=4.3×10﹣7 , Ki2=5.6×10﹣11
草酸:H2C2O4 , Ki1=5.9×10﹣2 , Ki2=6.4×10﹣5 0.1mol/L Na2CO3溶液的pH0.1mol/L Na2C2O4溶液的pH.(选填“大于”“小于”或“等于”)
等浓度草酸溶液和碳酸溶液中,氢离子浓度较大的是 .
若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是 . (选填编号)
a.[H+]>[HC2O4﹣]>[HCO3﹣]>[CO32﹣]b.[HCO3﹣]>[HC2O4﹣]>[C2O42﹣]>[CO32﹣]
c.[H+]>[HC2O4﹣]>[C2O42﹣]>[CO32﹣]d.[H2CO3]>[HCO3﹣]>[HC2O4﹣]>[CO32﹣].

