题目内容
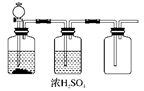
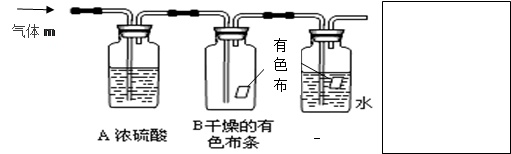
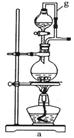
(8分)某同学应用如下所示装置研究物质的性质。其中气体m的主要成分是氯气,还含有少量空气和水蒸气。请回答下列问题:
(1)浓硫酸的作用是_______________。
(2)B中观察到的实验现象是 。
(3)从物质性质方面来看,这样的实验设计还存在事故隐患,应如何处理,请用离子方程式表达原理并画出装置图(填在上图内),

(1)浓硫酸的作用是_______________。
(2)B中观察到的实验现象是 。
(3)从物质性质方面来看,这样的实验设计还存在事故隐患,应如何处理,请用离子方程式表达原理并画出装置图(填在上图内),
( 1)除去水蒸气(2)有色布条不褪色
①Cl2+2OH-=Cl-+ClO-+H2O ②画图2分,吸收液注明正确1分
①Cl2+2OH-=Cl-+ClO-+H2O ②画图2分,吸收液注明正确1分
浓硫酸吸水干燥氯气,氯气,可以使不可以使干燥的有色布条褪色。氯气有毒不可以排放到空气中。

练习册系列答案
相关题目

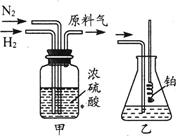
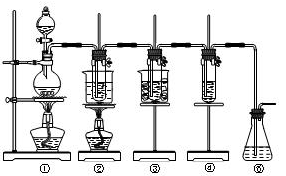
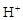 使石蕊变色
使石蕊变色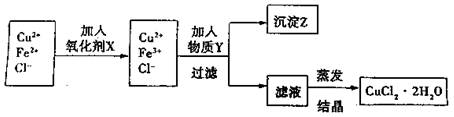
 始沉淀时的pH
始沉淀时的pH 。(填序号)
。(填序号) ++H2↑设计实验来制取CuCl2溶液,该同学设计的装置应该为 。(填“原电池”或“电解池”)
++H2↑设计实验来制取CuCl2溶液,该同学设计的装置应该为 。(填“原电池”或“电解池”)