题目内容
【题目】下列说法正确的是

A.图①中△H2=△H1+△H3
B.图②在催化剂条件下,反应的活化能等于E1+E2
C.图③表示醋酸溶液滴定 NaOH 和氨水混合溶液的电导率变化曲线
D.图④可表示由CO(g)生成CO2(g)的过程中要放出566kJ 热量
【答案】C
【解析】
试题分析:A.根据盖斯定律来可知:一个反应无论是一步完成还是分为数步完成,其热效应是相同的,图①中△H2=-(△H1+△H3),A错误;B.E1、E2分别代表反应过程中各步反应的活化能,整个反应的活化能为能量较高的E1,B错误;C、氢氧化钠是强电解质,氨水是弱电解质,滴加的弱电解质先和氢氧化钠反应生成强电解质醋酸钠,但溶液体积不断增大,溶液被稀释,所以电导率下降;当氢氧化钠完全被中和后,醋酸继续与弱电解质氨水反应生成强电解质醋酸铵,所以电导率增大;氨水也完全反应后,继续滴加醋酸,因为溶液被稀释,电导率有下降趋势,C正确;D、图象中未标明CO、氧气以及CO2的物质的量与焓变的值的数值计量关系,D错误;答案选C。

【题目】
(1)如图所示的仪器中配制溶液肯定不需要的是_______________(填序号),配制上述溶液还需用到的玻璃仪器是____________(填仪器的名称)。
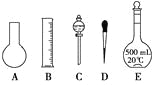
(2)下列操作中,容量瓶所不具备的功能有________(填序号)。
A.配制一定体积准确浓度的标准溶液 |
B.贮存溶液 |
C.测量容量瓶规格以下的任意体积的液体 |
D.准确稀释某一浓度的溶液 |
E.量取一定体积的液体
F.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为________g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度________0.1 mol/L(填“大于”、“等于”或“小于”,下同)。若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度________0.1 mol/L。
(4)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为________mL(计算结果保留一位小数)。如果实验室有15 mL、20 mL、50 mL量筒,应选用________mL量筒最好。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是______________________。