题目内容
【题目】将1.52 g铜镁合金完全溶解于50 mL密度为1.40 g·mL-1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体 1120 mL(标准状况),向反应后的溶液中加入1.0 mol·L-1NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是
A.该合金中铜与镁的物质的量之比是1∶2
B.该浓硝酸中HNO3的物质的量浓度是14.0 mol·L-1
C.NO2和N2O4的混合气体中,NO2的体积分数是80%
D.得到2.54 g沉淀时,加入NaOH溶液的体积是640 mL
【答案】A
【解析】
A. 设合金中Cu、Mg的物质的量分别为x、y,根据题目所给信息知64x+24y=1.52①;设金属为M,在反应过程中有:M-ne-=Mn+,Mn++nOH-=M(OH)n↓,可知:金属单质变为金属阳离子时失去电子的物质的量等于金属阳离子完全沉淀所需OH-的物质的量,氢氧根的物质的量是n(OH-)=![]() =0.06 mol,则有2x+2y=0.06②,由①②两式联立,解得x=0.02,y=0.01,所以该合金中铜与镁的物质的量之比是2:1,A错误;
=0.06 mol,则有2x+2y=0.06②,由①②两式联立,解得x=0.02,y=0.01,所以该合金中铜与镁的物质的量之比是2:1,A错误;
B. 硝酸的浓度是c=![]() mol/L=14.0 mol/L,B正确;
mol/L=14.0 mol/L,B正确;
C. 由上述分析可知,Cu、Mg共失去0.06 mol电子,根据得失电子守恒知,如果硝酸完全被还原为NO2,NO2的物质的量应为0.06 mol。现得到0.05 mol混合气体,是因为发生2NO2![]() N2O4,由差量法可知反应产生N2O40.01 mol,则其中含NO2为0.04 mol,故NO2的体积分数是
N2O4,由差量法可知反应产生N2O40.01 mol,则其中含NO2为0.04 mol,故NO2的体积分数是![]() ×100%=80%,C正确;
×100%=80%,C正确;
D. 反应产生2.54 g沉淀时溶液为NaNO3,根据硝酸根守恒可知硝酸钠n(NaNO3)=0.05 L×14 mol/L-0.06 mol=0.64 mol,则根据Na元素守恒可知反应消耗NaOH物质的量是0.64 mol,其体积V(NaOH)=![]() =0.64 L=640 mL,D正确;
=0.64 L=640 mL,D正确;
故合理选项是A。

【题目】下表是几种弱酸常温下的电离平衡常数:
CH3COOH | H2CO3 | H2S | H3PO4 |
1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
则下列说法中不正确的是( )
A. 碳酸的酸性强于氢硫酸
B. 多元弱酸的酸性主要由第一步电离决定
C. 常温下,加水稀释醋酸,![]() 增大
增大
D. 向弱酸溶液中加少量NaOH溶液,电离常数不变
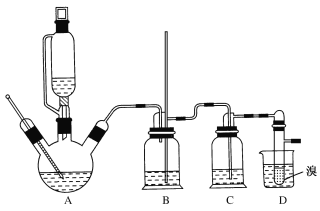
【题目】1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,不溶于水,易溶于醇等有机溶剂。实验室制备1,2-二溴乙烷的反应原理如下:
CH3CH2OH![]() CH2=CH2+H2O
CH2=CH2+H2O
CH2=CH2+Br2→BrCH2CH2Br
已知:①乙醇在浓硫酸存在下在140℃脱水生成乙醚
2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
②实验中常因温度过高而使乙醇和浓硫酸反应生成少量SO2和CO2,用12.0g溴和足量的乙醇制备1,2-二溴乙烷,实验装置如图所示:
有关数据列表如下:
类别 | 乙醇 | 1,2-二溴乙烷 | 乙醚 |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)在此制备实验中,A中按最佳体积比3﹕1加入乙醇与浓硫酸后,A中还要加入几粒碎瓷片,其作用是___。要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是___。
(2)装置B的作用是作安全瓶,瓶中盛水,除了可以防止倒吸以外,还可判断装置是否堵塞,若堵塞,B中现象是____。
(3)在装置C中应加入NaOH溶液,其目的是____。
(4)装置D中小试管内盛有液溴,判断该制备反应已经结束的最简单方法是___。
(5)将1,2—二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在___层(填“上”或“下”)。若产物中有少量未反应的Br2,最好用___洗涤除去;若产物中有少量副产物乙醚,可用____(填操作方法名称)的方法除去。
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是___。
(7)若实验结束后得到9.4g产品,1,2—二溴乙烷的产率为___。