题目内容
A、B、C、D是中学化学常见的四种物质,它们的转化关系如下: A + B = C + D
(1)若A、B、C都是非金属氧化物,且C在空气中易变成A,则A中非氧元素的气态氢化物M的电子
式为 ;分子的稳定性B M(填“>”、“<”或“=”)
(2)若A、D是两种单质,B是黑色有磁性的氧化物,B与盐酸反应生成溶液N,检验N溶液中低价金属阳离子的方法是 。
将D的粉末加入溶液N中,当有28gD完全溶解时,该反应转移的电子是 mol。
(3)若A、B、C、D发生反应:2CO2(g) + 6H2(g) = CH3CH2OH(g) + 3H2O(g),根据下图所示信息,
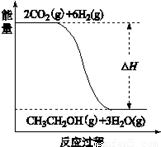
①反应是 反应(填“放热”或“吸热”),判断依据是
②若△H = a KJ/mol,当消耗标况下5.6 L CO2时的反应热 △H = KJ/mol。
③在恒温、恒容的密闭容器中,
下列描述能说明上述反应已达化学平衡状态的是 (填字母序号)。
A.生成1 mol CH3CH2OH的同时,生成3 mol H2O
B.容器中各组份的物质的量浓度不随时间而变化
C.容器中混合气体的密度不随时间而变化
D.容器中气体的分子总数不随时间而变化
(1)NH3的电子式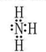 ,>
,>
(2)取反应后的溶液于试管中,滴加铁氰化钾溶液,溶液中有蓝色沉淀生成则含有Fe2;+或取反应后的溶液少量于试管中,滴加硫氰化钾,溶液不变红,再加新制氯水,溶液变红色,证明含有Fe2+;1
(3)①放热;反应物总能量高于生成物总能量 ② 0.125a ③ BD
【解析】
试题分析:(1) C在空气中易变成A,气态氧化物中有NO空气中变成NO2,则C为NO,A为NO2,B为水,D为硝酸。M为氨气,电子式为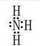 ,氧的非金属性强于氮,所以水的稳定性强于氨气,填“>”
,氧的非金属性强于氮,所以水的稳定性强于氨气,填“>”
(2) B是黑色有磁性的氧化物,B为四氧化三铁,与盐酸反应生成的低价金属阳离子是Fe2+,检验Fe2+的方法是取反应后的溶液少量于试管中,滴加铁氰化钾溶液,溶液中有蓝色沉淀生成则含有Fe2+,或取反应后的溶液少量于试管中,滴加硫氰化钾,溶液不变红,再加新制氯水,溶液变红色,证明含有Fe2+;D为单质铁,与N中的Fe3+反应生成Fe2+,28gFe溶解时,转移电子0.5mol×2=1mol
(3)①由图可知,反应物的总能量高于生成物的总能量,所以该反应为放热反应;
②△H = a KJ/mol,即2mol的CO2完全反应的热效应,标况下5.6LCO2的物质的量为0.25mol,其热效应为0.25/2×a KJ/mol=0.125a KJ/mol
③A、反应的任何状态都有生成1 mol CH3CH2OH的同时,生成3 mol H2O,错误;B、容器中各组份的物质的量浓度不随时间而变化,符合化学平衡的特征,正确;C、恒容容器中密度始终不变,错误;D、随反应的进行,气体分子数在减少,当达到平衡时,不再减少,保持不变,正确,答案选BD。
考点:考查物质推断,气态氢化物的稳定性的比较,离子检验,电子式的书写,热效应的计算,化学平衡的判断

 A、B、C、D是中学化学常见物质,其中A、B、C均含有同一种元素.在一定条件下相互转化关系如图,下列判断正确的是( )
A、B、C、D是中学化学常见物质,其中A、B、C均含有同一种元素.在一定条件下相互转化关系如图,下列判断正确的是( )| A、若D为H2O,A为碳,则A和C反应生成1 mol B转移的电子数为NA | ||
| B、若D为Fe,A为CI2,则B溶液蒸干后可得到纯净的B固体 | ||
| C、若D为O2,A为碱性气体,则以上转化只涉及两个氧化还原反应 | ||
D、若D为HCl,A为Na2CO3,则B溶液中c(Na+)=c(HCO3-)+2c(CO
|
 已知A、B、C、D是中学化学中常见的四种不同微粒,它们之间存在如图所示的转化关系.
已知A、B、C、D是中学化学中常见的四种不同微粒,它们之间存在如图所示的转化关系.

 已知A、B、C、D是中学化学中常见的四种不同粒子,而且均是10电子的粒子,它们之间存在如图所示的转化关系:
已知A、B、C、D是中学化学中常见的四种不同粒子,而且均是10电子的粒子,它们之间存在如图所示的转化关系:
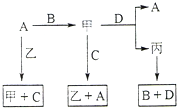 A、B、C、D 是中学化学常见的四种单质,甲、乙、丙为三种化合物,乙在常温下为无色无味的液体,各备物质间转化关系如图:(反应条件已略去),请填空:
A、B、C、D 是中学化学常见的四种单质,甲、乙、丙为三种化合物,乙在常温下为无色无味的液体,各备物质间转化关系如图:(反应条件已略去),请填空: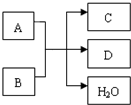 A、B、C、D是中学化学常见的物质,它们之间存在如图所示的转化关系.请按要求填空:
A、B、C、D是中学化学常见的物质,它们之间存在如图所示的转化关系.请按要求填空: