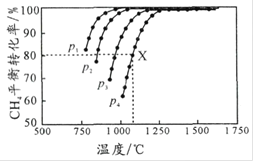
题目内容
【题目】常温下,将某一元酸HX和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
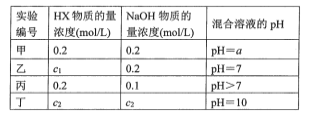
请回答:
(1)不考虑其他组的实验结果,单从甲组情况分析,若a ___7(填“>”“<”或“=”),则HX为强酸;若a ____ 7(填“>”“<”或“=”),则HX为弱酸。
(2)在乙组混合溶液中离子浓度c(X-)与c(Na+)的大小关系是____。
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,HX是___ 酸(填“强”或“弱”)。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=__mol/L。
【答案】= > C 弱 10-4
【解析】
(1)等体积、等浓度的一元酸和氢氧化钠恰好反应生成盐,根据盐溶液的酸碱性判断盐的类型,从而确定酸的强弱;(2)根据电荷守恒判断;(3)酸的浓度是碱的2倍,等体积混合时,溶液中的溶质是酸和盐,溶液呈碱性,说明酸根离子的水解程度大于酸的电离程度;(4)等浓度等体积的一元酸和氢氧化钠恰好反应生成盐,根据溶液的pH计算氢离子浓度,再根据水的离子积常数计算氢氧根离子浓度。
(1)等体积、等浓度的一元酸和氢氧化钠恰好反应生成盐,如果盐溶液呈中性,则盐是强酸强碱盐,酸是强酸,如果盐溶液呈碱性,则盐是强碱弱酸盐,酸是弱酸,故答案为:=;>;
(2)溶液中存在电荷守恒,c(X-)+c(OH-)=c(H+)+c(Na+),溶液呈中性,则c(OH-)=c(H+),所以c(X-)=c(Na+),故选C;
(3)酸的浓度是碱的2倍,等体积混合时,溶液中的溶质是酸和盐,溶液呈碱性,说明酸是弱酸;故答案为:弱;
(4)等浓度等体积的一元酸和氢氧化钠恰好反应生成盐,溶液中氢离子浓度为1×10-10 mol/L,根据水的离子积常数知,氢氧根离子浓度为10-4mol/L,故答案为:10-4。

 名校课堂系列答案
名校课堂系列答案